题目内容
5.向含有下列离子的溶液中分别加入烧碱固体(溶液体积变化可忽略),离子浓度保持不变的应该是下列选项中的( )| A. | OH- | B. | Na+ | C. | HCO3- | D. | Cl- |
分析 分别加入烧碱固体,溶液中OH-和Na+浓度保持增大,因HCO3-与OH-反应,它的浓度减小,以此解答该题.
解答 解:分别加入烧碱固体,溶液中OH-和Na+浓度保持增大,因HCO3-与OH-反应,它的浓度减小,而D中离子浓度不变,故选D.
点评 本题考查离子的性质,侧重于元素化合物知识的综合考查,难度不大,注意把握常见与OH-反应的离子的性质以及反应类型的判断.

练习册系列答案
 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
15.下列溶液一定呈中性的是( )
| A. | c(OH-)=$\sqrt{Kw}$的溶液 | B. | pH=7 的溶液 | ||
| C. | c(H+)=10-14的溶液 | D. | 加酚酞显无色的溶液 |
16.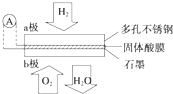 某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构如图,电池总反应可表示为:2H2+O2═2H2O,下列有关说法正确的是( )
某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构如图,电池总反应可表示为:2H2+O2═2H2O,下列有关说法正确的是( )
 某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构如图,电池总反应可表示为:2H2+O2═2H2O,下列有关说法正确的是( )
某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构如图,电池总反应可表示为:2H2+O2═2H2O,下列有关说法正确的是( )| A. | b极上的电极反应式为:O2+2H2O+4e-═4OH- | |
| B. | H+由a极通过固体酸电解质传递到b极 | |
| C. | 每转移0.1 mol电子,消耗1.12 L的H2 | |
| D. | 电子通过外电路从b极流向a极 |
13.卤代烃R-CH2-CH2-X中的化学键如图所示,则下列说法正确的是( )


| A. | 发生水解反应时,被破坏的键是①和③ | |
| B. | 发生消去反应时,被破坏的键是①和③ | |
| C. | 发生水解反应时,被破坏的键是① | |
| D. | 发生消去反应时,被破坏的键是①和② |
20.高铁酸钾(K2FeO4)是一种比Cl2、O3、KMnO4氧化性更强的多功能水处理剂.工业上可先制得高铁酸钠(离子反应为2Fe(OH)3+3ClO-+4OH-═2FeO${\;}_{4}^{2-}$+3Cl-+5H2O,然后在高铁酸钠溶液中加入一定量的KOH,可析出高铁酸钾.下列说法不正确的是( )
| A. | 高铁酸钾的还原产物易水解形成胶体,可使水中悬浮物凝聚沉降 | |
| B. | 工业上制备高铁酸钠时每生成1mol还原产物,转移3mol电子 | |
| C. | 高铁酸钾中Fe为+6价,具有强氧化性,能消毒杀菌 | |
| D. | 高铁酸钾能除去水中溶解的H2S等 |
10.一定温度下,wg下列物质在足量氧气中充分燃烧,产物与过量的过氧化钠完全反应,过氧化钠固体增重wg,符合此要求的是( )
①H2 ②CO ③CO和H2 ④HCOOCH3 ⑤HOOC-COOH ⑥C6H12O6 ⑦C12H22O11.
①H2 ②CO ③CO和H2 ④HCOOCH3 ⑤HOOC-COOH ⑥C6H12O6 ⑦C12H22O11.
| A. | 全部 | B. | 仅④⑤ | C. | 仅①②③ | D. | 除⑤⑦外 |
17.下列说法中正确的是( )
| A. | 某个多电子原子的3p能级上仅有两个电子,它们的自旋状态必然相反 | |
| B. | 在一个多电子原子中,不可能有两个运动状态完全相同的电子 | |
| C. | 在一个多电子原子中,不可能有两个能量相同的电子 | |
| D. | 在一个多电子原子中,N层上的电子能量肯定比M层上的电子能量高 |
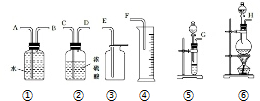 现有一定量的乙醚和乙醇的混合物试样.请从图中选用适当的实验装置,设计一个最简单的实验,测定试样中乙醇的含量.可供选用的反应物和试剂为:新制的生石灰、浓硫酸、蒸馏水、金属钠、碱石灰、无水硫酸铜.
现有一定量的乙醚和乙醇的混合物试样.请从图中选用适当的实验装置,设计一个最简单的实验,测定试样中乙醇的含量.可供选用的反应物和试剂为:新制的生石灰、浓硫酸、蒸馏水、金属钠、碱石灰、无水硫酸铜.