题目内容
16.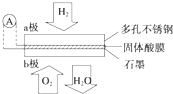 某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构如图,电池总反应可表示为:2H2+O2═2H2O,下列有关说法正确的是( )
某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构如图,电池总反应可表示为:2H2+O2═2H2O,下列有关说法正确的是( )| A. | b极上的电极反应式为:O2+2H2O+4e-═4OH- | |
| B. | H+由a极通过固体酸电解质传递到b极 | |
| C. | 每转移0.1 mol电子,消耗1.12 L的H2 | |
| D. | 电子通过外电路从b极流向a极 |
分析 由电池总反应为2H2+O2=2H2O可知:通入氢气的一极为电池的负极,发生氧化还原反应,反应为H2-2e-═2H+,通入氧气的一极为电池的正极,发生氧化反应,反应为O2+4e-+4H+=2H2O;电池工作时,电子通过外电路从负极流向正极,即从a极流向b极,电解质溶液中阳离子向正极移动,即H+由a极通过固体酸电解质传递到b极;每转移0.1mol电子,消耗0.05mol的H2,以此解答该题.
解答 解:A.电解质传递H+,则b极上的电极反应式为O2+4e-+4H+=2H2O,故A错误;
B.原电池中,阳离子向正极移动,所以H+由a极通过固体酸电解质传递到b极,故B正确;
C.每转移0.1mol电子,消耗0.05mol的H2,标准状况下的H2 1.12 L,而状态未知,不能计算体积,故C错误;
D.电子通过外电路从负极流向正极,即从a极流向b极,故D错误;
故选B.
点评 本题考查原电池原理,为高频考点,侧重考查学生灵活运用原电池原理解决实际问题的能力.学习中要明确原电池电子以及离子的定向移动问题,要能正确判断原电池的正负极,以及电极反应式的书写等问题,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.已知 X、Y、Z、Q、R、E六种元素中,原子序数X<Y<Z<Q<R<E,其结构或性质信息如下表.
请根据信息回答有关问题:
(1)元素Y的原子核外共有7种不同运动状态的电子,有3种不同能级的电子;
(2)X、Y、Z三种元素的电负性由高到低的排列次序依次为(写元素符号)O>N>C;
(3)X、Z、Q元素均表现最低化合价时的三种氢化物中,沸点由高到低的排列次序依次为(写化学式)H2O>HCl>CH4;
(4)R的最高化合价为+6.R的一种配合物的化学式为RCl3•6H2O.已知0.01molRCl3•6H2O在水溶液中用过量硝酸银溶液处理,产生0.02molAgCl沉淀.此配合物最可能是B;
A.[R(H2O)6]Cl3 B.[R(H2O)5Cl]Cl2•H2O
C.[R(H2O)4Cl2]Cl•2H2O D.[R(H2O)3Cl3]•3H2O
(5)元素E能形成八面体构型的配合物离子[E(YH3)xQ2]+,则中心离子为(写化学式)Co3+,配位体为(写化学式)NH3和Cl-,x的值为4;
(6)Y的最低价氢化物与Z的一种氢化物反应,生成的两种产物均不污染环境,其反应的化学方程式为2NH3+3H2O2═N2+6H2O.
| 元素 | 结构或性质信息 |
| X | 原子的L层上s电子数等于p电子数. |
| Y | 原子核外的L层有3个未成对电子. |
| Z | 在元素周期表的各元素中电负性仅小于氟. |
| Q | 单质常温、常压下是气体,原子的M层上有1个未成对的p电子. |
| R | 核电荷数是Y与Q的核电荷数之和 |
| E | 原子序数比R大3 |
(1)元素Y的原子核外共有7种不同运动状态的电子,有3种不同能级的电子;
(2)X、Y、Z三种元素的电负性由高到低的排列次序依次为(写元素符号)O>N>C;
(3)X、Z、Q元素均表现最低化合价时的三种氢化物中,沸点由高到低的排列次序依次为(写化学式)H2O>HCl>CH4;
(4)R的最高化合价为+6.R的一种配合物的化学式为RCl3•6H2O.已知0.01molRCl3•6H2O在水溶液中用过量硝酸银溶液处理,产生0.02molAgCl沉淀.此配合物最可能是B;
A.[R(H2O)6]Cl3 B.[R(H2O)5Cl]Cl2•H2O
C.[R(H2O)4Cl2]Cl•2H2O D.[R(H2O)3Cl3]•3H2O
(5)元素E能形成八面体构型的配合物离子[E(YH3)xQ2]+,则中心离子为(写化学式)Co3+,配位体为(写化学式)NH3和Cl-,x的值为4;
(6)Y的最低价氢化物与Z的一种氢化物反应,生成的两种产物均不污染环境,其反应的化学方程式为2NH3+3H2O2═N2+6H2O.
7.茉莉花香气成分中含有茉莉酮,其香味浓郁,被广泛应用于化妆品的制造中,其结构简式为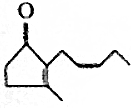 .
.
(1)一分子该有机物中的碳原子数为11,分子式为C11H16O.
(2)该有机物分子中含有的官能团有碳碳双键、羰基.
 .
.(1)一分子该有机物中的碳原子数为11,分子式为C11H16O.
(2)该有机物分子中含有的官能团有碳碳双键、羰基.
4.某同学从自家厨房找到一些被大量花生油污染的粗盐固体,此粗盐中还混有 Mg2+、Ca2+、SO42-等杂质,该同学欲将该粗盐提纯,得到纯净的氯化钠固体.请你帮助他从以下操作中选择正确操作和顺序 ( )
①过滤②加过量NaOH溶液;③加适量稀盐酸;④加过量Na2CO3溶液;⑤加过量BaCl2溶液;⑥静置分液;⑦蒸发结晶;⑧加适量水溶解.
①过滤②加过量NaOH溶液;③加适量稀盐酸;④加过量Na2CO3溶液;⑤加过量BaCl2溶液;⑥静置分液;⑦蒸发结晶;⑧加适量水溶解.
| A. | ②⑤④①③ | B. | ⑧④①②⑤③⑦ | C. | ⑧⑥②⑤④①③⑦ | D. | ⑧②④⑤①⑥③⑦ |
1.根据下表信息,判断以下叙述正确的是( )
部分短周期元素的原子半径及主要化合价
部分短周期元素的原子半径及主要化合价
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | R与T形成的化合物RT3中,各原子均满足8电子的稳定结构 | |
| B. | 单质与稀盐酸反应产生氢气的剧烈程度为L<Q | |
| C. | M与T形成的化合物具有两性 | |
| D. | L2+与R2-的核外电子数相等 |
8.断裂下列化学键需要吸收的能量分别为:H-H 436kJ/mol F-F 153kJ/mol H-F 565kJ/mol下列说法正确的是( )
| A. | H2与F2反应的热化学方程式为:H2(g)+F2(g)═2HF(g)△H=-541 kJ | |
| B. | 2 L HF气体分解成1 L H2和1 L F2吸收541 kJ的热量 | |
| C. | 1 mol H2与1 mol F2反应生成2 mol液态HF放出的热量小于541 kJ | |
| D. | 在相同条件下,1 mol H2与1 mol F2的能量总和大于2 mol HF气体的能量 |
5.向含有下列离子的溶液中分别加入烧碱固体(溶液体积变化可忽略),离子浓度保持不变的应该是下列选项中的( )
| A. | OH- | B. | Na+ | C. | HCO3- | D. | Cl- |
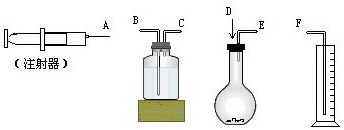 现有如下药品和装置:w克锌片(w<1g)、稀H2SO4、水,设计一个实验,测Zn的相对原子质量(假定实验是在标准状况下进行的).
现有如下药品和装置:w克锌片(w<1g)、稀H2SO4、水,设计一个实验,测Zn的相对原子质量(假定实验是在标准状况下进行的).