题目内容
【题目】(1)甲醇(CH3OH)是重要的溶剂和替代燃料,工业上用CO和H2在一定条件下制备CH3OH的反应为:CO(g)+2H2(g)![]() CH3OH(g),在体积为1L的恒容密闭容器中,充入2molCO和4molH2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间变化如图一所示。
CH3OH(g),在体积为1L的恒容密闭容器中,充入2molCO和4molH2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间变化如图一所示。

①从反应开始到5min,用CO表示的平均反应速率v(CO)=________。
②下列说法正确的是____________(填字母序号)。
A.达到平衡时,H2的转化率为65%
B.5min后容器中混合气体的平均相对分子质量不再改变
C.达到平衡后,再充入氩气,反应速率减小
D.2min前v(正)>v(逆),2min后v(正)<v(逆)
(2)碳与水蒸气反应制取H2的相关反应如下:
Ⅰ:C(s)+H2O(g)=CO(g)+H2(g) △H=+131.0kJ/mol
Ⅱ:CO(g)+H2O(g)=CO2(g)+H2(g) △H= - 43kJ/mol
Ⅲ:CaO(s)+CO2(g)=CaCO3(S) △H= - 178.3kJ/mol
①计算反应ⅣC(s)+2H2O(g)+CaO(s)![]() CaCO3(s)+2H2(g)的△H=_______kJ/mol;
CaCO3(s)+2H2(g)的△H=_______kJ/mol;
若K1、K2、K3分别为反应Ⅰ、Ⅱ、Ⅲ的平衡常数,则反应Ⅳ平衡常数K=__________(用K1、K2、K3表示)。
②对于可逆反应C(s)+2H2O(g)+CaO(s) ![]() CaCO3(s)+2H2(g),采取以下措施可以提高H2产率的是________。(填字母)
CaCO3(s)+2H2(g),采取以下措施可以提高H2产率的是________。(填字母)
A.降低体系的温度 B.压缩容器的体积 C.增加CaO的量 D.选用适当的催化剂
(3)对于可逆反应C(s)+2H2O(g)+CaO(s) ![]() CaCO3(s)+2H2(g),该反应_______(填“能”或“不能”)自发进行。
CaCO3(s)+2H2(g),该反应_______(填“能”或“不能”)自发进行。
【答案】 0.3mol/(L·min) B -90.3 K1·K2·K3 A 能
【解析】(1)①v(CO)=△c/△t=(2.0-0.5)mol/L/5min=0.3mol/(L·min);②A.达到平衡时,H2的转化率为(2.0-0.5)mol/L ×1L×2/4mol=75%,A错误;B.5min后反应达到平衡状态,容器中混合气体的平均相对分子质量不再改变,B正确;C.达到平衡后,再充入氩气,浓度不变,反应速率不变,C错误;D.在反应达到平衡前,v(正)>v(逆),D错误。答案选B。 (2)①由盖斯定律可知,将已知三个方程式相加即得到反应Ⅳ,C(s)+2H2O(g)+CaO(s)![]() CaCO3(s)+2H2(g)的△H=-90.3kJ/mol;方程式相加,平衡常数相乘,反应Ⅳ平衡常数K= K1·K2·K3;②A.正反应是放热反应,降低体系的温度,平衡正向移动,可以提高H2产率,A正确;B.压缩容器的体积,平衡不移动,B错误;C.增加CaO的量,平衡不移动,C错误;D.选用适当的催化剂,平衡不移动,D错误;答案选A。(3)此反应为放热反应,且没有熵变,可以自发进行。
CaCO3(s)+2H2(g)的△H=-90.3kJ/mol;方程式相加,平衡常数相乘,反应Ⅳ平衡常数K= K1·K2·K3;②A.正反应是放热反应,降低体系的温度,平衡正向移动,可以提高H2产率,A正确;B.压缩容器的体积,平衡不移动,B错误;C.增加CaO的量,平衡不移动,C错误;D.选用适当的催化剂,平衡不移动,D错误;答案选A。(3)此反应为放热反应,且没有熵变,可以自发进行。

 智慧小复习系列答案
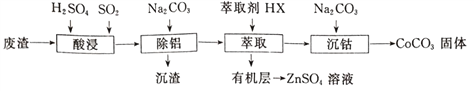
智慧小复习系列答案【题目】CoCO3可用作选矿剂、催化剂及伪装涂料的颜料。以含钴废渣(主要成CoO、Co2O3,还含有Al2O3、ZnO等杂质)为原料制备CoCO3的一种工艺流程如下:
下表是相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol·L-1计算):
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Co2+ | 7.6 | 9.4 |
Al3+ | 3.0 | 5.0 |
Zn2+ | 5.4 | 8.0 |
(1)写出“酸溶”时发生氧化还原反应的化学方程式_________________。
(2)“除铝”过程中需要调节溶液pH的范围为______________,形成沉渣时发生反应的离子方程式为_____________________。
(3)在实验室里,萃取操作用到的玻璃仪器主要有____________;上述“萃取”过程可表示为ZnSO4(水层)+2HX(有机层) ![]() ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是_________________________。
ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是_________________________。
(4)“沉钴”时,Na2CO3溶液滴加过快会导致产品不纯,请解释原因_________________。
(5)在空气中煅烧CoCO3生成钴氧化物和CO2,测得充分煅烧后固体质量为2.41g,CO2的体积为0.672L(标准状况),则该钴氧化物的化学式为____________________。