题目内容
【题目】已知A是一种常见金属,F是一种红褐色沉淀。试根据图中转化关系,回答下列问题。
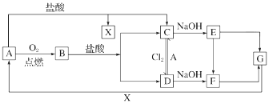
(1)写出A、C、F、G的化学式:A________;C________;F________;G________。
(2)保存C溶液时要加固体A的原因是______________________。
(3)写出下列转化的离子方程式。
①D→C:___________________________________________________;
②C→D:___________________________________________________;
③B→C+D__________________________________________________。
(4)写出E→F的化学方程式:__________________________________。
【答案】Fe FeCl2 Fe(OH)3 Fe2O3 防止Fe2+被O2氧化 2Fe3++Fe===3Fe2+ 2Fe2++Cl2===2Fe3++2Cl- Fe3O4+8H+===2Fe3++Fe2++4H2O 4Fe(OH)2+O2+2H2O===4Fe(OH)3
【解析】
A是一种常见金属,F是一种红褐色沉淀,由转化关系可知F为Fe(OH)3,A为Fe;Fe与氧气反应生成B为Fe3O4,四氧化三铁与盐酸反应得到氯化亚铁与氯化铁,故Fe与盐酸反应得到X为氢气、C为FeCl2,可推知E为Fe(OH)2、D为FeCl3,G为Fe2O3;C溶液为FeCl2溶液,亚铁离子易被氧化为铁离子,根据铁离子与铁单质反应生成亚铁离子分析解答。
A是一种常见金属,F是一种红褐色沉淀,由转化关系可知F为Fe(OH)3,A为Fe,Fe与氧气反应生成B为Fe3O4,四氧化三铁与盐酸反应得到氯化亚铁与氯化铁,故Fe与盐酸反应得到X为氢气、C为FeCl2,可推知E为Fe(OH)2、D为FeCl3,G为Fe2O3;
(1)由上述分析可知,A为Fe,C为FeCl2,F为Fe(OH)3,G为Fe2O3;综上所述,本题答案是:Fe,FeCl2,Fe(OH)3 ,Fe2O3。
(2)FeCl2易被空气中氧气氧化,保存FeCl2溶液时加固体Fe,防止Fe2+被氧气氧化;综上所述,本题答案是:防止Fe2+被O2氧化。
(3)①氯化铁与铁反应生成氯化亚铁,D→C的反应离子方程式为:2Fe3++Fe===3Fe2+;综上所述,本题答案是:2Fe3++Fe===3Fe2+。
②氯化亚铁与氯气反应生成氯化铁,C→D的反应离子方程式为:2Fe2++Cl2===2Fe3++2Cl- ;综上所述,本题答案是:2Fe2++Cl2===2Fe3++2Cl- 。
③四氧化三铁与盐酸反应生成氯化铁、氯化亚铁和水,B→C+D的反应离子方程式为:Fe3O4+8H+===2Fe3++Fe2++4H2O;综上所述,本题答案是:Fe3O4+8H+===2Fe3++Fe2++4H2O。
(4)氢氧化亚铁与氧气和水反应生成氢氧化铁,E→F的反应化学方程式为:4Fe(OH)2+O2+2H2O===4Fe(OH)3;综上所述,本题答案是:4Fe(OH)2+O2+2H2O===4Fe(OH)3。

 阅读快车系列答案
阅读快车系列答案