题目内容
【题目】反应①是制备SiH4的一种方法,利用其副产物可制备相应物质,有关转化关系如下:
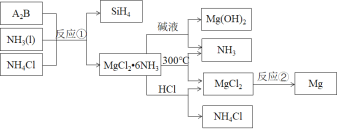
下列说法不正确的是( )
A.A2B的化学式为Mg2Si
B.NH3、NH4Cl可以循环使用
C.反应①中参加反应的NH3和NH4Cl的物质的量之比为1∶1
D.反应②中每生成24gMg转移2mol电子
【答案】C
【解析】
根据化学反应的本质,反应①的产物中出现Si和Mg元素,结合Mg为+2价、Si为-4价,可知A2B应为Mg2Si,与氨气、氯化铵反应生成SiH4和MgCl26NH3,MgCl26NH3加入碱液,可生成Mg(OH)2,MgCl26NH3加热时不稳定,可分解生成氨气,同时生成氯化镁,电解熔融的氯化镁,可生成镁,用于工业冶炼,而MgCl26NH3与盐酸反应,可生成氯化镁、氯化铵,其中氨气、氯化铵可用于反应①而循环使用,以此解答该题。
A.由分析知,A2B应为Mg2Si,故A正确;
B.由分析知,产物氨气、氯化铵可用于反应①而循环使用,故B正确;
C.反应①发生反应的化学方程式为Mg2Si+8NH3+4NH4Cl=SiH4+2MgCl26NH3,则参加反应的NH3和NH4Cl的物质的量之比为2:1,故C错误;
D.反应②中电解MgCl2生成Mg,其中Mg元素从+2价降为0价,则每生成24g(1mol)Mg转移2mol电子,故D正确;
故答案为C。

练习册系列答案
相关题目