题目内容
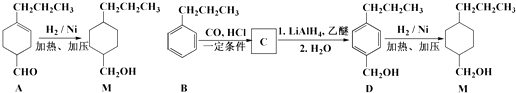
【题目】常温下,将等体积的盐酸和氨水分别加水稀释,溶液的导电性与溶液体积的变化曲线如图所示,下列说法正确的是

A. 曲线II表示氨水加水稀释过程中溶液导电性的变化
B. 溶液的pH大小关系:c>b>d
C. 若将bd两点溶液混合,则c(Cl-)>c(NH4+)>c(H+)>c(OH-)
D. 由水电离出n(OH-):b>c
【答案】D
【解析】图中分析可以知道开始导电能力相同说明开始氢氧根离子浓度和氢离子浓度相同,加水稀释促进一水合氨电离平衡正向进行,氢氧根离子浓度大于盐酸溶液中氢离子浓度,导电能力强,则曲线Ⅰ表示氨水加水稀释过程中溶液导电性的变化,A错误;盐酸溶液PH小于一水合氨,稀释过程中盐酸溶液PH增大,溶液的pH大小关系:![]() ,B错误;
,B错误;
图中分析可以知道开始导电能力相同说明开始氢氧根离子浓度和氢离子浓度相同,加水稀释促进一水合氨电离平衡正向进行,稀释相同倍数,氨水溶液中氢氧根离子浓度大于盐酸溶液中氢离子浓度,若将b、d两点溶液混合后溶液显碱性,c(NH4+)>c(Cl-)>c(OH-)> c(H+),C错误;因为氨水是弱电解质,HCl是强电解质,稀释相同倍数后,氨水导电能力强,所以氨水中水的电离程度小,而b、c两点的导电能力相同,由水电离出的n(OH-):b>c,D正确;正确选项D。

练习册系列答案
相关题目