题目内容
| |||||||||
答案:1.略;2.略;
解析:
解析:
(1) |
|
(2) |
|

练习册系列答案
相关题目
| 相同温度下,体积均为0.25L的两个恒容密闭容器中发生可逆反应:X2(g)+3Y2(g)?2XY3(g)△H=-92.6kJ.mol-1 实验测得反应在起始、达到平衡时的有关数据如下表所示:
| |||||||||||||||||||||
某研究小组进行H2O2的性质探究,设计如下几组实验,完成相关内容
(1)H2O2的氧化性:在试管中加入3mL新制的FeSO4溶液,再加入几滴KSCN溶液和稀硫酸,最后加入H2O2溶液.出现的现象是 .
(2)H2O2的还原性:在试管中加入5mL H2O2溶液,加入硫酸酸化的KMnO4溶液,振荡,发现溶液褪色,用带火星的木条伸入试管内,木条复燃.该反应的离子方程式为 .
(3)H2O2的分解:实验如下:
①对比实验1和实验2,得出结论为 .
②对比实验3和实验4,得出结论为 .
③该组实验中H2O2溶液浓度必须 .
(1)H2O2的氧化性:在试管中加入3mL新制的FeSO4溶液,再加入几滴KSCN溶液和稀硫酸,最后加入H2O2溶液.出现的现象是
(2)H2O2的还原性:在试管中加入5mL H2O2溶液,加入硫酸酸化的KMnO4溶液,振荡,发现溶液褪色,用带火星的木条伸入试管内,木条复燃.该反应的离子方程式为
(3)H2O2的分解:实验如下:
| 实验1 | 实验2 | 实验3 | 实验4 | |
| 操作 | 2mL H2O2溶液 | 2mL H2O2溶液 | 2mL H2O2溶液 两滴FeCl3溶液 |
2mL H2O2溶液 两滴过氧化氢酶溶液 |
| 室温 | 90℃(水浴) | 室温 | 室温 | |
| 现象 | 无气泡 | 较少气泡 | 较多气泡 | 很多气泡 |
②对比实验3和实验4,得出结论为
③该组实验中H2O2溶液浓度必须


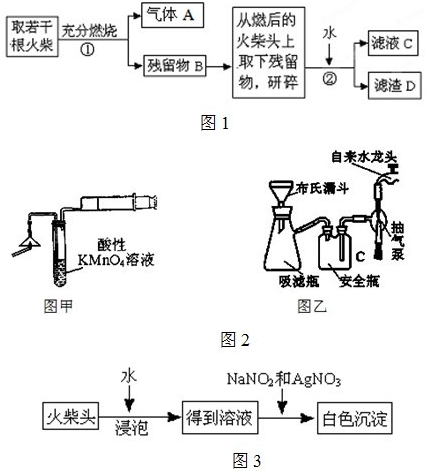
 中NO(g)、CO(g)、N2(g)的物质的量浓度变化如图所示,则反应进行到15min时,NO的平均反应速率为
中NO(g)、CO(g)、N2(g)的物质的量浓度变化如图所示,则反应进行到15min时,NO的平均反应速率为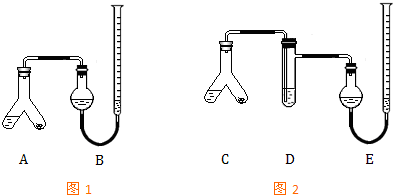 某实验小组分别用图1、2装置测定某种钙片中碳酸钙的含量,夹持装置已略去.
某实验小组分别用图1、2装置测定某种钙片中碳酸钙的含量,夹持装置已略去.