题目内容
(2009?宿迁模拟)环境问题备受世界关注.化工厂以及汽车尾气排放的一氧化碳(CO)、氮氧化物(NOx)、硫化物等气体已成为大气污染的主要因素.
(1)CO的中毒是由于CO与血液中血红蛋白的血红素部分反应生成碳氧血红蛋白,反应方程式可表示为:CO+Hb?O2?O2+Hb?CO
实验表明,c(Hb?CO)即使只有c(Hb?O2)的
,也可造成人的智力损伤.
已知t℃时上述反应的平衡常数K=200,吸入肺部O2的浓度约为1.0×10-2mol?L-1,若使c(Hb?CO)小于c(Hb?O2)的
,则吸入肺部CO的浓度不能超过
(2)汽车尾气治理的方法之一是在汽车的排气管上安装一个“催化转化器”.
已知反应2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-113kJ?mol-1
①实验发现该反应在100℃~400℃的温度范围内,温度每升高10℃,反应速率约为原来的3倍,在400℃~450℃时,温度每升高10℃,反应速率却约为原来的10倍,而温度高于450℃时,温度每升高10℃,反应速率又约为原来的3倍.若其他反应条件不变,试分析造成这种现象的可能原因是
②为了模拟催化转化器的工作原理,在t℃时,将2molNO与1mol CO充入1L反应容器中,反应过程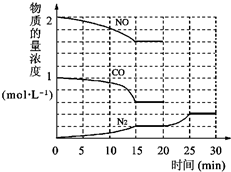 中NO(g)、CO(g)、N2(g)的物质的量浓度变化如图所示,则反应进行到15min时,NO的平均反应速率为
中NO(g)、CO(g)、N2(g)的物质的量浓度变化如图所示,则反应进行到15min时,NO的平均反应速率为
③请在图中画出20min~30min内NO、CO发生变化的曲线,引起该变化的条件可能是
a.加入催化剂
b.降低温度
c.缩小容器体积
d.增加CO2的物质的量
④当25min达到平衡后,若保持体系温度为t1℃,再向容器中充入NO、N2气体各1mol,平衡将
(1)CO的中毒是由于CO与血液中血红蛋白的血红素部分反应生成碳氧血红蛋白,反应方程式可表示为:CO+Hb?O2?O2+Hb?CO
实验表明,c(Hb?CO)即使只有c(Hb?O2)的
| 1 |
| 50 |
已知t℃时上述反应的平衡常数K=200,吸入肺部O2的浓度约为1.0×10-2mol?L-1,若使c(Hb?CO)小于c(Hb?O2)的
| 1 |
| 50 |
1.0×10-6
1.0×10-6
mol?L-1.(2)汽车尾气治理的方法之一是在汽车的排气管上安装一个“催化转化器”.
已知反应2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-113kJ?mol-1
①实验发现该反应在100℃~400℃的温度范围内,温度每升高10℃,反应速率约为原来的3倍,在400℃~450℃时,温度每升高10℃,反应速率却约为原来的10倍,而温度高于450℃时,温度每升高10℃,反应速率又约为原来的3倍.若其他反应条件不变,试分析造成这种现象的可能原因是
催化剂在400℃~450℃活性最大
催化剂在400℃~450℃活性最大
;②为了模拟催化转化器的工作原理,在t℃时,将2molNO与1mol CO充入1L反应容器中,反应过程
 中NO(g)、CO(g)、N2(g)的物质的量浓度变化如图所示,则反应进行到15min时,NO的平均反应速率为
中NO(g)、CO(g)、N2(g)的物质的量浓度变化如图所示,则反应进行到15min时,NO的平均反应速率为0.027mol?L-1?min-1
0.027mol?L-1?min-1
;③请在图中画出20min~30min内NO、CO发生变化的曲线,引起该变化的条件可能是
d
d
;(填字母)a.加入催化剂
b.降低温度
c.缩小容器体积
d.增加CO2的物质的量
④当25min达到平衡后,若保持体系温度为t1℃,再向容器中充入NO、N2气体各1mol,平衡将
向左
向左
移动(填“向左”、“向右”或“不”).分析:(1)根据平衡常数K=
=200代入公式计算;
(2)①根据催化剂的活性受温度影响;
②根据V=
来计算;
③根据氮气的变化来确定NO、CO的变化;结合图象根据外界条件对化学平衡的影响来判断;
④先根据三段法求出各自的浓度,然后求出平衡常数和浓度熵,最后根据平衡常数的大小与浓度熵的大小来确定平衡移动方向;
| c(O2)×c(Hb?CO) |
| c(CO)×c(Hb?O2) |
(2)①根据催化剂的活性受温度影响;
②根据V=
| ||
| △t |
③根据氮气的变化来确定NO、CO的变化;结合图象根据外界条件对化学平衡的影响来判断;
④先根据三段法求出各自的浓度,然后求出平衡常数和浓度熵,最后根据平衡常数的大小与浓度熵的大小来确定平衡移动方向;
解答:解:(1)根据平衡常数K=
=200K,若使c(Hb?CO)小于c(Hb?O2)的 1/50,且吸入肺部O2的浓度约为1.0×10-2mol?L-1,则有
>200×50,则吸入肺部CO的浓度不能超过
=1.0×10-6mol?L-1,
故答案为:1.0×10-6;
(2)①因催化剂的活性受温度影响,由信息可知催化剂在400℃~450℃活性最大;
故答案为:催化剂在400℃~450℃活性最大
②由图象可知在15min内NO的物质的量变化0.4mol,则NO的平均反应速率为=
mol?L-1?min-1=0.027 mol?L-1?min-1
③氮气的变化的物质的量与NO、CO的变化的物质的量成正比,25分钟后达到平衡,图象为:
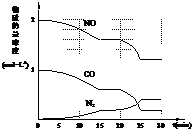
由图象可知,平衡向正反应方向移动,
a、加入催化剂,平衡不移动,故a错误;
b、降低温度,平衡向正反应方向移动,故b正确;
c、缩小容器体积,平衡向正反应方向移动,达平衡时,浓度应大于25min时的浓度,故c错误;
d、增加CO2的物质的量,平衡向逆反应方向移动,氮气的平衡浓度降低,故d错误.
故答案为: ;b;
;b;
④2NO(g)+2CO(g)?N2(g)+2CO2(g)
| c(O2)×c(Hb?CO) |
| c(CO)×c(Hb?O2) |
| c(O2) |
| c(CO) |
| 1.0×10-2mol?L-1 |
| 10000 |
故答案为:1.0×10-6;
(2)①因催化剂的活性受温度影响,由信息可知催化剂在400℃~450℃活性最大;
故答案为:催化剂在400℃~450℃活性最大
②由图象可知在15min内NO的物质的量变化0.4mol,则NO的平均反应速率为=
| ||
| 15 |
③氮气的变化的物质的量与NO、CO的变化的物质的量成正比,25分钟后达到平衡,图象为:

由图象可知,平衡向正反应方向移动,
a、加入催化剂,平衡不移动,故a错误;
b、降低温度,平衡向正反应方向移动,故b正确;
c、缩小容器体积,平衡向正反应方向移动,达平衡时,浓度应大于25min时的浓度,故c错误;
d、增加CO2的物质的量,平衡向逆反应方向移动,氮气的平衡浓度降低,故d错误.
故答案为:
 ;b;
;b;④2NO(g)+2CO(g)?N2(g)+2CO2(g)
点评:本题主要考查了平衡常数的计算、外界条件对平衡的影响,难度中等.

练习册系列答案
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案
相关题目