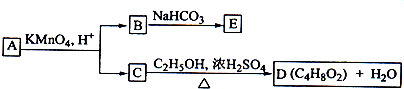
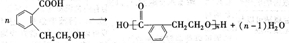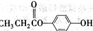题目内容
A、B、C、D、E均为可溶于水的固体,组成它们的离子有:
|
阳离子 |
Na+ Mg2+ Al3+ Ba2+ |
|
阴离子 |
OH- Cl- |
分别取它们的水溶液进行实验,结果如下:
①A溶液与B溶液反应生成白色沉淀,沉淀可溶于E溶液;②A溶液与C溶液反应生成白色沉淀,沉淀可溶于E溶液;③A溶液与D溶液反应生成白色沉淀,沉淀可溶于盐酸;④B溶液与适量D溶液反应生成白色沉淀,加入过量D溶液,沉淀量减小,但不消失。
据此推断它们是:
A____________;B____________;C____________; D____________;E____________。
【答案】
Na2CO3 Al2(SO4)3 MgCl2 Ba(OH)2 NaHSO4或Mg(HSO4)2
【解析】
试题分析:根据①②可以推出E为酸或酸式盐,但根据提供的阳离子没有H+,可知E只能为酸式盐,根据A溶液与B、C、D都产生白色沉淀,推知A为Na2CO3,根据④可知B为Al2(SO4)3,D为Ba(OH)2,从而推出C为MgCl2,E为NaHSO4或Mg(HSO4)2。
考点:考查离子共存以及物质鉴别的有关判断
点评:该题是高考中的常见题型,属于中等难度的试题,试题综合性强,侧重对学生能力的培养,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力。该题的解题关键是找到突破口,然后顺藤摸瓜,依次推出相关物质。

练习册系列答案
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案
相关题目