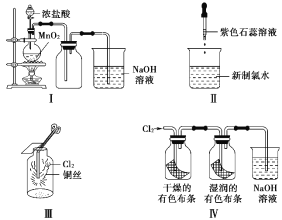
题目内容
【题目】如图是配制100mL2mol·L-1的NaOH的溶液过程示意图:
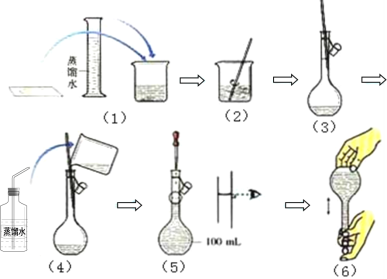
(1)步骤(3)(4)(5)(6)都涉及同一仪器,此仪器的名称为___。
(2)配制此溶液时,需称取NaOH固体的质量为___g。
(3)步骤(6)操作后,发现液面下降,这时___(填“需要”或“不需要”)再加水至刻度线。
(4)实验时,如果没有步骤(4)的操作,所得溶液的物质的量浓度将___;定容时俯视刻度会导致浓度___(填“偏高”“不变”或“偏低)。
【答案】100mL容量瓶 8.0 不需要 偏低 偏高
【解析】
(1)根据图示分析判断,需要注明仪器的规格;
(2)根据n=cV计算出氢氧化钠的物质的量,再根据m=nM计算出需要氢氧化钠的质量;
(3)由于摇匀后,在容量瓶刻度线上方有残留的溶液,所以液面低于刻度线属于正常现象;
(4)根据c=![]() 分析判断误差。
分析判断误差。
(1)根据图示,第(3)(4)(5)(6)步实验都使用到容量瓶,本实验中使用的规格为100mL,故答案为:100mL容量瓶;
(2)配制100mL2molL-1的NaOH的溶液,需要氢氧化钠的质量为:2molL-1×0.1L×40g/mol=8.0g,故答案为:8.0;
(3)摇匀后,由于容量瓶刻度线上方有残留的溶液,所以会出现液面低于刻度线的现象,不需要再加水至刻度线,否则会导致配制的溶液体积偏大,浓度偏低,故答案为:不需要;
(4)如果没有步骤(4)的操作,即若不洗涤烧杯和玻璃棒,会导致配制的溶液中溶质的物质的量偏小,根据c=![]() 可得,配制的溶液浓度偏低;定容时俯视刻度,会导致溶液的体积偏小,则浓度偏高,故答案为:偏低;偏高。
可得,配制的溶液浓度偏低;定容时俯视刻度,会导致溶液的体积偏小,则浓度偏高,故答案为:偏低;偏高。

练习册系列答案
相关题目