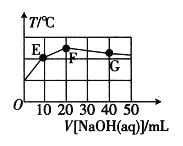
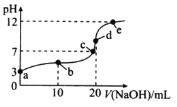
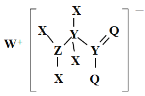题目内容
【题目】常温下,电解质溶液的性质与变化是多样的,下列说法正确的是
A.往稀氨水中加水,溶液中的![]() 值变小
值变小
B.pH相等的①CH3COONa、②NaClO、③NaOH三种溶液中c(Na+)大小:①>②>③
C.pH=4的H2S溶液与pH=10的NaOH溶液等体积混合,存在下列等式:c(Na+)+c(H+)=c(OH-)+2c(S2-)
D.Ca(ClO)2溶液中通入少量CO2,ClO-水解程度增大,溶液碱性增强
【答案】B
【解析】
A、往稀氨水中加水,![]() =
=![]() =常数,所以结果是不变化的,故A错误;
=常数,所以结果是不变化的,故A错误;
B、氢氧化钠是强碱,完全电离,显碱性,醋酸根离子和次氯酸根离子水解显示碱性,且醋酸根离子的水解程度小于次氯酸根离子,所以pH相同的①CH3COONa ②NaClO ③NaOH三种溶液c(Na+)大小:①>②>③,故B正确;
C、根pH=4的H2S溶液与pH=10的NaOH溶液等体积混合,存在电荷守恒:c(Na+)+c(H+)=c(OH-)+2c(S2-)+c(HS-),故C错误;
D、Ca(ClO)2溶液中通入少量CO2,发生反应生成碳酸钙和次氯酸,溶液显示酸性,故D错误。
故选B。

 春雨教育同步作文系列答案
春雨教育同步作文系列答案【题目】Ⅰ.某小组以CoCl2·6H2O、过氧化氢、液氨、氯化铵固体为原料,在活性炭催化下,合成了橙黄色晶体X。为确定其组成,进行如下实验:
①氨的测定:精确称取wgX,加适量水溶解,注入圆底烧瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品溶液中的氨全部蒸出,用V1mL c1mol·L-1的盐酸溶液吸收。蒸氨结束后取下接收瓶,用c2mol·L-1 NaOH标准溶液滴定过剩的HCl,到终点时消耗V2mLNaOH溶液。
②氯的测定:准确称取样品X配成溶液后用AgNO3标准溶液滴定,K2CrO4溶液为指示剂,至出现砖红色沉淀不在消失为终点(Ag2CrO4为砖红色)。
回答下列问题:
(1)用NaOH标准溶液滴定过剩的HCl时,应使用___式滴定管,该滴定实验可使用的指示剂为___,达到滴定终点的现象为___。
(2)样品中氨的质量分数表达式为___。
(3)滴定终点时,若溶液中c(Ag+)=2.0×10-5mol·L-1 ,c(CrO42-)为___mol·L-1。(已知:Ksp(Ag2CrO4)=1.12×10-12)。
Ⅱ.已知
化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-17 | 10-17 | 10-39 |
(4)则用废电池的锌皮制作七水合硫酸锌,需去除少量杂质铁,其方法是:加入稀硫酸和双氧水,溶解,铁变为___加入___调节pH为___(保留两位有效数字),铁刚好完全沉淀(离子浓度小于1×10-5mol/L时,即可认为该离子沉淀完全)。
【题目】下列实验能达到实验目的的是______ 。
序号 | 实验内容 | 实验目的 |
A | 盛有 | 探究浓度对反应速率的影响 |
B | 用石墨电极电解 | 比较确定铜和镁的金属活动性强弱 |
C | 在容积可变的密闭容器中发生反应:2NO2(g) | 正反应速率加快,逆反应速率减慢 |
D | 向2支试管中各加入相同体积、相同浓度的 | 探究温度对反应速率的影响 |
A.AB.BC.CD.D
【题目】下列实验方案中,可以达到实验目的的是( )
选项 | 实验目的 | 实验方案 |
A | 检验亚硫酸钠是否变质 | 先将亚硫酸钠样品溶于水配成溶液,然后加入足量稀盐酸酸化,再加入 |
B | 除去苯中混有的苯酚 | 加入适量的溴水,充分反应后过滤,弃去沉淀 |
C | 除去NaCl晶体中混有 | 先将晶体溶于水配成溶液,然后蒸发结晶并趁热过滤弃去滤液 |
D | 检验 | 将 |
A.AB.BC.CD.D