题目内容
绿矾是一种重要的化工原料。
【问题1】绿矾晶体(FeSO4·7H2O)由于保存不妥或长久放置,容易被空气中的氧气氧化而变质。为探究绿矾样品的变质情况,某化学兴趣小组的同学设计了下列实验方案。
实验准备:取少量绿矾样品,用蒸馏水在烧杯中配成溶液。
(1)方案1:取少量溶液,加入几滴 试剂(写化学式),如果观察到的现象是溶液变血红色;实验结论:证明绿矾样品已被氧化。
(2)方案2:取少量溶液,加入几滴酸性KMnO4溶液,如果观察到的现象是 。实验结论:证明绿矾样品完全被氧化。
(3)使用FeSO4时,如要防止Fe3+的干扰,可以加入适量铁粉进行除杂,写出加入铁粉后发生反应的离子方程式 。
(4)要从FeSO4溶液中得到绿矾晶体,必须进行的实验操作步骤: 、冷却结晶、 过滤、自然干燥,在这一系列操作中没有用到的仪器有 (此空填序号)
A.蒸发皿 B.石棉网 C.烧杯 D.玻璃棒
【问题2】灼烧绿矾的反应方程式:2(FeSO4·7H2O) Fe2O3+SO2↑+SO3↑+14H2O
工业上常通过高温分解FeSO4的方法制备Fe2O3,为检验FeSO4高温分解的气体产物中是否含有SO2和SO3,进行如下实验:将FeSO4高温分解产生的气体通入下图所示的装置中。请回答以下问题:
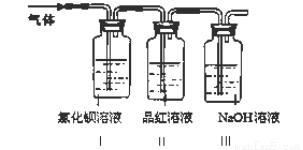
(1)装置I中氯化钡溶液中可观察到现象 。若氯化钡溶液足量,将最后所得沉淀过滤、洗涤、烘干后称重为2.33克,则灼烧绿矾的过程中转移了_________mol的电子。
(2)装置II中试剂为品红溶液,其作用是
(3)装置III中试剂为NaOH溶液,其作用是 。
【问题1】 (1)KSCN
(2)溶液不褪色
(3)Fe+ 2Fe 3+=3Fe2+
(4)蒸发浓缩;B
【问题2】 (1)有白色沉淀产生 0.02
(2)检验产生的气体中是否含SO2,
(3)除去多余的SO2,防止污染空气。
【解析】
试题分析:【问题1】(1)绿矾中的亚铁离子被氧化成铁离子,遇KSCN变红色,因此加入KSCN溶液,若溶液变红证明被氧化
(2)酸性KMnO4可氧化亚铁离子,但不与铁离子反应,若溶液的紫色不退去,证明已完全被氧化
(3)铁与铁离子反应生成亚铁离子,离子方程式为Fe+ 2Fe3+=3Fe2+
(4)从溶液中得到晶体的第一步是蒸发浓缩;这一系列的操作中A、蒸发皿中进行蒸发,C、烧杯中配成溶液,D、用玻璃棒进行搅拌,没有用的的是B石棉网
【问题2】(1)三氧化硫与氯化钡溶液反应生成硫酸钡白色沉淀,所以装置I中氯化钡溶液中可观察到现象是有白色沉淀产生;2.33g为硫酸钡,其物质的量为0.01mol,即三氧化硫的物质的量为0.01mol,根据绿矾分解是化学方程式可计算该过程中转移电子的物质的量为0.02mol
(2)品红溶液用来验证气体产物中是否含二氧化硫
(3)试剂为NaOH溶液用来吸收多余的二氧化硫,防止污染空气
考点:考查铁离子、亚铁离子的检验及其化学性质,二氧化硫、三氧化硫的检验及尾气处理,从溶液中得到固体的方法操作