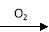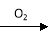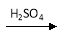题目内容
下列反应中,调节反应物用量或浓度不会改变反应产物的是 ( )
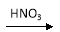
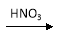
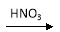
A、CO2通入石灰水 B、硝酸中加入铜片
C、硫酸中加入锌粉 D、HCl溶液滴入NaHCO3溶液
D
【解析】
试题分析:A、少量二氧化碳与石灰水反应产生沉淀,过量则无沉淀产生,错误;B、铜与稀硝酸反应的气体产物是一氧化氮,与浓硝酸反应的气体产物是二氧化氮,错误;C、稀硫酸与锌反应生成氢气和硫酸锌,浓硫酸与锌反应则不产生氢气,错误;D、HCl溶液滴入NaHCO3溶液生成二氧化碳和氯化钠,与量无关,正确,答案选D。
考点:考查化学中与量有关的化学反应

练习册系列答案
相关题目