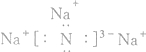题目内容
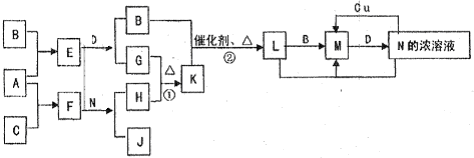
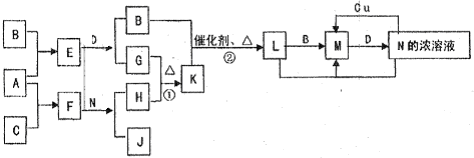
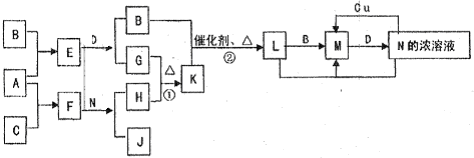
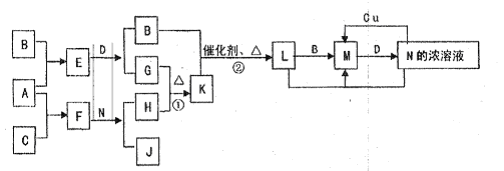
已知A-L所代表的物质(或溶液中的溶质)都是中学化学里常见的物质.通常状况下,A是淡黄色固体,D是气体单质,E是无色无味气体,K是不溶于水的酸.反应①②③是以B为原料生产化学工业重要产品的全部反应,反应④是工业生产普通玻璃的反应之一.一定条件下,各物质间的相互转化关系如图所示(反应时加入或生成的水均没标出).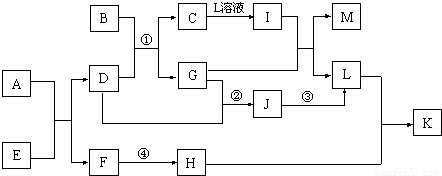
请填写下列空白:
(1)写出下列物质的化学式:A ;B ;L .
(2)画出A中金属元素的原子结构示意图 ;指出E分子中共价键的类型(填“极性键”或“非极性键”) .
(3)完成下列反应方程式:
①I+G→M+L的离子方程式: .
②写出反应④的化学方程式: .
【答案】分析:已知A-L所代表的物质(或溶液中的溶质)都是中学化学里常见的物质.通常状况下,A是淡黄色固体,结合转化关系判断化合物为Na2O2;D是气体单质,E是无色无味气体判断为CO2,所以推断D为O2,F为Na2CO3;K是不溶于水的酸判断为H2SiO3;反应④是工业生产普通玻璃的反应之一,所以推断H为Na2SiO3;L为酸,反应①②③是以B为原料生产化学工业重要产品的全部反应,是制备酸的反应,G+D=J,J为氧化物推断G为SO2,J为SO3,L为H2SO4;C+L=I,分析判断C为金属氧化物,I能把G(SO2)氧化为H2SO4,所以推知B为制硫酸的原料为FeS2,C为Fe2O3;I为Fe2(SO4)3,M为FeSO4;依据判断出的物质分析判断.
解答:解:已知A-L所代表的物质(或溶液中的溶质)都是中学化学里常见的物质.通常状况下,A是淡黄色固体,结合转化关系判断化合物为Na2O2;D是气体单质,E是无色无味气体判断为CO2,所以推断D为O2,F为Na2CO3;K是不溶于水的酸判断为H2SiO3;反应④是工业生产普通玻璃的反应之一,所以推断H为Na2SiO3;L为酸,反应①②③是以B为原料生产化学工业重要产品的全部反应,是制备酸的反应,G+D=J,J为氧化物推断G为SO2,J为SO3,L为H2SO4;C+L=I,分析判断C为金属氧化物,I能把G(SO2)氧化为H2SO4,所以推知B为制硫酸的原料为FeS2,C为Fe2O3;I为Fe2(SO4)3,M为FeSO4;
(1)依据上述分析判断,A为Na2O2 ,B为FeS2,L为H2SO4,故答案为:Na2O2;FeS2;H2SO4;
(2)A中金属元素为钠,原子结构示意图为:Na ;E分子为CO2,分子中共价键的类型为极性键,故答案为:
;E分子为CO2,分子中共价键的类型为极性键,故答案为: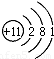 ;极性键;
;极性键;
(3)①I+G→M+L的反应是硫酸铁和二氧化硫的反应,反应离子方程式为:2Fe3++SO2+2H2O═2Fe2++SO42-+4H+,故答案为:2Fe3++SO2+2H2O═2Fe2++SO42-+4H+;
②反应④是工业生产普通玻璃的反应之一,是二氧化硅和碳酸钠在高温下反应生成硅酸钠和二氧化碳,反应的化学方程式:Na2CO3+SiO2 Na2SiO3+CO2↑,
Na2SiO3+CO2↑,
故答案为:Na2CO3+SiO2 Na2SiO3+CO2↑;
Na2SiO3+CO2↑;
点评:本题考查了物质推断的转化关系的分析应用,物质性质的推断应用,主要考查工业制备硫酸的工艺流程,氧化铁的氧化性,化学方程式的书写,掌握物质性质及其转化关系是解题关键,题目难度中等.
解答:解:已知A-L所代表的物质(或溶液中的溶质)都是中学化学里常见的物质.通常状况下,A是淡黄色固体,结合转化关系判断化合物为Na2O2;D是气体单质,E是无色无味气体判断为CO2,所以推断D为O2,F为Na2CO3;K是不溶于水的酸判断为H2SiO3;反应④是工业生产普通玻璃的反应之一,所以推断H为Na2SiO3;L为酸,反应①②③是以B为原料生产化学工业重要产品的全部反应,是制备酸的反应,G+D=J,J为氧化物推断G为SO2,J为SO3,L为H2SO4;C+L=I,分析判断C为金属氧化物,I能把G(SO2)氧化为H2SO4,所以推知B为制硫酸的原料为FeS2,C为Fe2O3;I为Fe2(SO4)3,M为FeSO4;
(1)依据上述分析判断,A为Na2O2 ,B为FeS2,L为H2SO4,故答案为:Na2O2;FeS2;H2SO4;
(2)A中金属元素为钠,原子结构示意图为:Na
 ;E分子为CO2,分子中共价键的类型为极性键,故答案为:
;E分子为CO2,分子中共价键的类型为极性键,故答案为: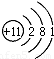 ;极性键;
;极性键;(3)①I+G→M+L的反应是硫酸铁和二氧化硫的反应,反应离子方程式为:2Fe3++SO2+2H2O═2Fe2++SO42-+4H+,故答案为:2Fe3++SO2+2H2O═2Fe2++SO42-+4H+;
②反应④是工业生产普通玻璃的反应之一,是二氧化硅和碳酸钠在高温下反应生成硅酸钠和二氧化碳,反应的化学方程式:Na2CO3+SiO2
 Na2SiO3+CO2↑,
Na2SiO3+CO2↑,故答案为:Na2CO3+SiO2
 Na2SiO3+CO2↑;
Na2SiO3+CO2↑;点评:本题考查了物质推断的转化关系的分析应用,物质性质的推断应用,主要考查工业制备硫酸的工艺流程,氧化铁的氧化性,化学方程式的书写,掌握物质性质及其转化关系是解题关键,题目难度中等.

练习册系列答案
相关题目
下图每一方框中的字母代表一种反应物或生成物。

(1)若X由M、N两种短周期且同周期元素组成,M原子的最外层电子数是最内层电子数的![]() ,N元素最高价与它的负价代数和为6。
,N元素最高价与它的负价代数和为6。
①写出反应Ⅱ的离子方程式______________________________。
②下图为反应Ⅳ达平衡后改变反应条件,反应速率随时间变化的情况,已知t2—t3阶段为使用催化剂;t3—t4阶段为减小体系的压强,写出符合上述条件的化学方程式___________________(写一个即可,用具体物质表示);若t4—t5阶段为升高体系的温度,则该反应为___________________(填“放热”或“吸热”)。

③某温度下,四个容器中均进行着上述反应,各物质的物质的量浓度及正逆反应速率关系如下表所示。请填写表中相应的空格。
容器编号 | c(C)/mol·L-1 | c(D)/mol·L-1 | c(G)/mol·L-1 | v正、v逆比较 |
甲 | 0.06 | 0.60 | 0.60 | v正=v逆 |
乙 | 0.06 | 0.50 | 0.40 |
|
丙 | 0.12 | 0.40 | 0.80 | v正<v逆 |
丁 | 0.12 | 0.30 |
| v正=v逆 |
(2)若X是一种含氧酸盐,B是金属单质,C、D是非金属单质,反应Ⅱ需要B与A的浓溶液共热才能进行,且生成的E与G是同一种物质。写出反应Ⅰ的化学方程式___________________;