题目内容
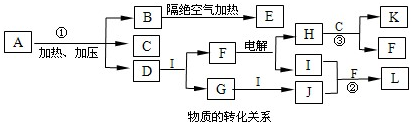
下图每一方框中的字母代表一种反应物或生成物。
(1)若X由M、N两种短周期且同周期元素组成,M原子的最外层电子数是最内层电子数的![]() ,N元素最高价与它的负价代数和为6。
,N元素最高价与它的负价代数和为6。
①写出反应Ⅱ的离子方程式______________________________。
②下图为反应Ⅳ达平衡后改变反应条件,反应速率随时间变化的情况,已知t2—t3阶段为使用催化剂;t3—t4阶段为减小体系的压强,写出符合上述条件的化学方程式___________________(写一个即可,用具体物质表示);若t4—t5阶段为升高体系的温度,则该反应为___________________(填“放热”或“吸热”)。

③某温度下,四个容器中均进行着上述反应,各物质的物质的量浓度及正逆反应速率关系如下表所示。请填写表中相应的空格。
容器编号 | c(C)/mol·L-1 | c(D)/mol·L-1 | c(G)/mol·L-1 | v正、v逆比较 |
甲 | 0.06 | 0.60 | 0.60 | v正=v逆 |
乙 | 0.06 | 0.50 | 0.40 |
|
丙 | 0.12 | 0.40 | 0.80 | v正<v逆 |
丁 | 0.12 | 0.30 |
| v正=v逆 |
(2)若X是一种含氧酸盐,B是金属单质,C、D是非金属单质,反应Ⅱ需要B与A的浓溶液共热才能进行,且生成的E与G是同一种物质。写出反应Ⅰ的化学方程式___________________;
(1)①Cl2+2OH-![]() Cl-+ClO-+H2O
Cl-+ClO-+H2O
②H2(g)+I2(g)![]() 2HI(g)(其他合理答案也可) 放热
2HI(g)(其他合理答案也可) 放热
③v正>v逆 0.60
(2)2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4
2Cu+O2↑+2H2SO4
S(s)+O2(g)![]() SO2(g) ΔH=-297.6 kJ·mol-1
SO2(g) ΔH=-297.6 kJ·mol-1
解析:M为Na,N为Cl,
①Cl2+2OH-![]() Cl-+ClO-+H2O
Cl-+ClO-+H2O
②t3—t4阶段减压,v正=v逆,该反应ΔVg=0。
如H2(g)+I2(g)![]() 2HI(g)
2HI(g)
t4—t5段升高温度v逆>v正,平衡向逆向移动,正反应方向是放热反应。
③甲K=![]() =10
=10
乙Qc=![]() =5.3<10,Qc<K,平衡向正向移动,v正>v逆。
=5.3<10,Qc<K,平衡向正向移动,v正>v逆。
丁:![]() ×0.3=10,c(G)=0.6 mol·L-1
×0.3=10,c(G)=0.6 mol·L-1
(2)此时X为CuSO4,A为H2SO4,B为Cu,C为O2,D为S,E为SO2,F为CuO,G为SO2。
反应Ⅰ为2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4
2Cu+O2↑+2H2SO4
C+D![]() G,S(s)+O2(g)
G,S(s)+O2(g)![]() SO2(g) ΔH=-297.6 kJ·mol。
SO2(g) ΔH=-297.6 kJ·mol。


 NH4++NH2-
NH4++NH2-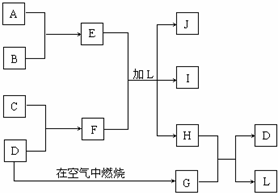 下图每一方框中的字母代表一种反应物或生成物:
下图每一方框中的字母代表一种反应物或生成物:
