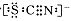题目内容
(15分)高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:
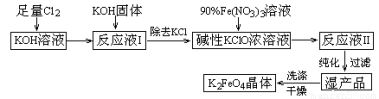
已知:① 2KOH + Cl2 = KCl + KClO + H2O(条件:温度较低)
② 6KOH + 3Cl2 = 5KCl + KClO3 + 3H2O(条件:温度较高)
③ 2Fe(NO3)3 + 2KClO + 10KOH = 2K2FeO4 + 6KNO3 + 3KCl + 5H2O
回答下列问题:
(1)该生产工艺应在 (填“温度较高”或“温度较低”)的情况下进行;
(2)写出工业上制取Cl2的化学方程式 ;
(3)K2FeO4可作为新型多功能水处理剂的原因 ;
(4)与MnO2 — Zn电池类似,K2FeO4 — Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为________,该电池总反应的离子方程式为_____。
(5)在“反应液I ”中加KOH固体的目的是① ,② ;
(6)从“反应液II ”中分离出K2FeO4后,副产品是 (写化学式)。
(1)温度较低(2)2NaCl + 2H2O  2NaOH + H2↑ + Cl2↑
2NaOH + H2↑ + Cl2↑
(3)+6价的Fe元素易得电子表现出强氧化性,可杀菌消毒;还原产物Fe元素为+3价,在水中形成Fe(OH)3胶体,可吸附水中悬浮物并可使泥沙聚沉。
(4)FeO42-+3e-+4H2O= Fe(OH)3+5OH-;2FeO42-+8H2O+3Zn= 2Fe(OH)3+ 3Zn(OH)3+4OH-
(5)与“反应液I”中过量的Cl2继续反应,生成更多的KClO;为下一步反应提供反应物
(6)KNO3 KCl
【解析】
试题分析:(1)根据反应方程式可知:该生产工艺应在温度较低的情况下进行;(2)在工业上一般用电解法制取氯气。制取Cl2的化学方程式为2NaCl + 2H2O  2NaOH + H2↑ + Cl2↑。(3)K2FeO4中的Fe+6价,易得电子表现出强氧化性,可杀菌消毒;还原产物Fe元素为+3价,在水中形成Fe(OH)3胶体,可吸附水中悬浮物并可使泥沙聚沉。因此可作为新型多功能水处理剂。(4)K2FeO4 — Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式是FeO42-+3e-+4H2O= Fe(OH)3+5OH-;该电池总反应的离子方程式为2FeO42-+8H2O+3Zn= 2Fe(OH)3+ 3Zn(OH)3+4OH-。(5)在“反应液I ”中加KOH固体的目的有两个。①是与“反应液I”中过量的Cl2继续反应,生成更多的KClO;②是为下一步反应提供反应物。(6)根据反应方程式2Fe(NO3)3 + 2KClO + 10KOH = 2K2FeO4 + 6KNO3 + 3KCl + 5H2O可知:从“反应液II ”中分离出K2FeO4后,副产品是KNO3 和KCl。
2NaOH + H2↑ + Cl2↑。(3)K2FeO4中的Fe+6价,易得电子表现出强氧化性,可杀菌消毒;还原产物Fe元素为+3价,在水中形成Fe(OH)3胶体,可吸附水中悬浮物并可使泥沙聚沉。因此可作为新型多功能水处理剂。(4)K2FeO4 — Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式是FeO42-+3e-+4H2O= Fe(OH)3+5OH-;该电池总反应的离子方程式为2FeO42-+8H2O+3Zn= 2Fe(OH)3+ 3Zn(OH)3+4OH-。(5)在“反应液I ”中加KOH固体的目的有两个。①是与“反应液I”中过量的Cl2继续反应,生成更多的KClO;②是为下一步反应提供反应物。(6)根据反应方程式2Fe(NO3)3 + 2KClO + 10KOH = 2K2FeO4 + 6KNO3 + 3KCl + 5H2O可知:从“反应液II ”中分离出K2FeO4后,副产品是KNO3 和KCl。
考点:考查反应条件的选择、物质的制取方法、方程式与电极式的书写等知识。

(15分)甲醇是重要的化学工业基础原料和清洁液体燃料。工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
化学反应 | 平衡常数 | 温度℃ | |
500 | 800 | ||
①2H2(g)+CO(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g) | K2 | 1.0 | 2.50 |
③3H2(g)+CO2(g) | K3 |
|
|
(1)反应②是 (填“吸热”或“放热”)反应。
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如下图所示。则平衡状态由A变到B时,平衡常数K(A) K(B)(填“>”、“<”或“=”)。据反应①与②可推导出K1、K2与K3之间的关系,则K3= (用K1、K2表示)。

(3)在3 L容积可变的密闭容器中发生反应②,已知c(CO)与反应时间t变化曲线Ⅰ如图所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。
当曲线Ⅰ变为曲线Ⅱ时,改变的条件是 。
当曲线Ⅰ变为曲线Ⅲ时,改变的条件是 。

(4)甲醇燃料电池有着广泛的用途,同时Al—AgO电池是应用广泛的鱼雷电 池,其原 理 如右图所示。该电池的负极反应式是 。

(5)一定条件下甲醇与一氧化碳反应可以合成乙酸。通常状况下,将a mol/L的醋酸与b mol/L Ba(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)=c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数为 。