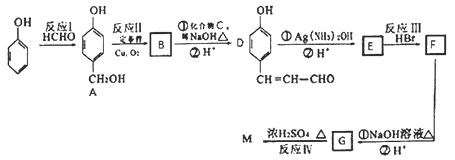
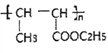题目内容
【题目】在密闭容器中进行反应:X2(g)+Y2(g)![]() 2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.2 mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )
2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.2 mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )
A. Z为0.3 mol·L-1 B. Y2为0.4 mol·L-1
C. X2为0.2 mol·L-1 D. Z为0.4 mol·L-1
【答案】A
【解析】试题分析:A.若X2完全反应,则生成Z 0.2mol/L,而实际上可逆反应不能进行到底,所以Z的浓度范围为0<Z<0.4mol/L,Z有可能是0.3mol/L,不可能为0.4mol/L,A项正确,D项错误;B.若Z完全反应生成Y2为0.1 mol·L-1,,则此时Y2的浓度为0.4mol/L,X2 0.1mol/L,实际上可逆反应不能进行彻底,所以Y2不可能为0.4 mol·L-1 ,Z不可能为0.4mol/L,B项错误;C项错误;答案选A。

【题目】分别取40 mL的0.50 mol/L盐酸与40 mL0.55 mol/L氢氧化钠溶液进行中和反应.通过测定反应过程中所放出的热量可计算中和热.请回答下列问题.
(1)理论上稀强酸、稀强碱反应生成1 mol水时放出57.3 kJ的热量,写出表示稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式______________________________
(2)如图所示,A为泡沫塑料板,上面有两个小孔,分别插入温度计和环形玻璃棒,两个小孔不能开得过大,其原因是__________________;反应需要多次测量温度,每次测量温度后在进行下一次测量以前都必须采取的操作是____________________.
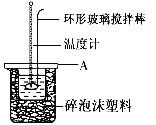
(3)假设盐酸和氢氧化钠溶液的密度都是1 g/cm3,又知中和后生成溶液的比热容c=4.18 J/(g·℃).为了计算中和热,实验时还需测量的数据有(填序号)__________;
A.反应前盐酸溶液的温度 B.反应前盐酸溶液的质量 C.反应前氢氧化钠溶液的温度
D.反应前氢氧化钠溶液的质量 E.反应后混合溶液的最高温度 F.反应后混合溶液的质量
(4)某学生实验记录数据如下:
实验 序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | 氢氧化钠 | 混合溶液 | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
依据该学生的实验数据计算,该实验测得的中和热ΔH=____________;
(5)假定该学生的操作完全同上,实验中改用100 mL 0.5 mol/L盐酸跟100 mL 0.55 mol/L氢氧化钠溶液进行反应,与上述实验相比,所放出的热量_______(填“相等”或“不相等”),所求中和热__________(填“相等”或“不相等”).