��Ŀ����
����Ŀ���ֱ�ȡ40 mL��0.50 mol/L������40 mL0.55 mol/L����������Һ�����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȣ���ش��������⣮
��1��������ϡǿ�ᡢϡǿ�Ӧ����1 molˮʱ�ų�57.3 kJ��������д����ʾϡ�����ϡ����������Һ��Ӧ���к��ȵ��Ȼ�ѧ����ʽ______________________________
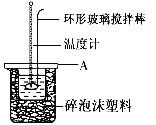
��2����ͼ��ʾ��AΪ��ĭ���ϰ壬����������С�ף��ֱ�����¶ȼƺͻ��β�����������С�ײ��ܿ��ù�����ԭ����__________________����Ӧ��Ҫ��β����¶ȣ�ÿ�β����¶Ⱥ��ڽ�����һ�β�����ǰ�������ȡ�IJ�����____________________��
��3���������������������Һ���ܶȶ���1 g/cm3����֪�кͺ�������Һ�ı�����c��4.18 J/(g����)��Ϊ�˼����к��ȣ�ʵ��ʱ���������������(�����)__________��
A����Ӧǰ������Һ���¶� B����Ӧǰ������Һ������ C����Ӧǰ����������Һ���¶�
D����Ӧǰ����������Һ������ E����Ӧ������Һ������¶� F����Ӧ������Һ������
��4��ijѧ��ʵ���¼�������£�
ʵ�� ��� | ��ʼ�¶�t1/�� | ��ֹ�¶�t2/�� | |
���� | �������� | �����Һ | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
���ݸ�ѧ����ʵ�����ݼ��㣬��ʵ���õ��к��Ȧ�H��____________��
��5���ٶ���ѧ���IJ�����ȫͬ�ϣ�ʵ���и���100 mL 0.5 mol/L�����100 mL 0.55 mol/L����������Һ���з�Ӧ��������ʵ����ȣ����ų�������_______(���ȡ�����ȡ�)�������к���__________(���ȡ�����ȡ�)��
���𰸡� NaOH(aq)��![]() H2SO4(aq)===
H2SO4(aq)===![]() Na2SO4(aq)��H2O(l)����H����57.3 kJ/mol ����������ʧ ��ˮ���¶ȼ��ϵ�Һ���� A��C��E ��51.8 kJ/mol ����� ���
Na2SO4(aq)��H2O(l)����H����57.3 kJ/mol ����������ʧ ��ˮ���¶ȼ��ϵ�Һ���� A��C��E ��51.8 kJ/mol ����� ���
����������1����֪ϡǿ�ᡢϡǿ�Ӧ����1molҺ̬ˮʱ�ų�57.3kJ��������ϡ�������������ϡ��Һ����ǿ���ǿ���ϡ��Һ����Ӧ���Ȼ�ѧ����ʽΪ��NaOH(aq)��1/2H2SO4(aq)��1/2 Na2SO4(aq)��H2O(l)����H����57.3 kJ/mol��
��2����ͼ��ʾ��AΪ��ĭ���ϰ壬����������С�ף��ֱ�����¶ȼƺͻ��β����������������С���ù��ᵼ��ɢʧ�϶��������Ӱ��ⶨ������кͷ�Ӧ�Ƿ��ȷ�Ӧ���¶ȼ��ϵ�����NaOH��Һ��Ӧ���ȣ�ʹ�¶ȼƶ������ߣ��¶Ȳ�ƫ�ͣ�ʹ��õ��к���ƫ�ߣ�����ÿ�β�������ˮ���¶ȼ��ϵ�Һ�������������¶ȼƣ�
��3����Q=cm��T��֪���ⶨ�к�����Ҫ�ⶨ������Ϊ��A����Ӧǰ������Һ���¶���C����Ӧǰ����������Һ���¶Ⱥ�E����Ӧ������Һ������¶ȣ���ѡACE��
��4����1��ʵ�������NaOH��Һ��ʼƽ���¶�Ϊ20.05������Ӧ���¶�Ϊ��23.2������Ӧǰ���¶Ȳ�Ϊ��3.15�棻��2��ʵ�������NaOH��Һ��ʼƽ���¶�Ϊ20.3������Ӧǰ���¶Ȳ�Ϊ��3.1�棻��3��ʵ�������NaOH��Һ��ʼƽ���¶�Ϊ20.55������Ӧǰ���¶Ȳ�Ϊ��3.05�棻40mL��0.50mol/L������40mL��0.55mol/L����������Һ��������Ϊm=80mL��1g/cm3=80g��c=4.18J/��g���������빫ʽQ=cm��T�õ�����0.02mol��ˮ�ų�����Q=4.18J/��g�棩��80g��(3.15��+3.1��+3.05��)/3=1036J��1.036kJ��������0.02mol��ˮ�ų�����Ϊ��1.036kJ����������1mol��ˮ�ų�����Ϊ��1.036kJ��1mol/0.02mol=51.8kJ/mol������ʵ���õ��к�����H=-51.8kJ/mol��
��5����Ӧ�ų����������������Լ�������Ķ����йأ�����100mL 0.50mol/L�����100mL 0.55mol/L NaOH��Һ���з�Ӧ��������ʵ����ȣ�����ˮ�������ӣ����ų����������ӣ������к�����ָǿ���ǿ�Ӧ����1molˮʱ�ų����ȣ������������أ�������100mL 0.50mol/L�����100mL 0.55mol/L NaOH��Һ��������ʵ�飬����к�����ֵ�����
