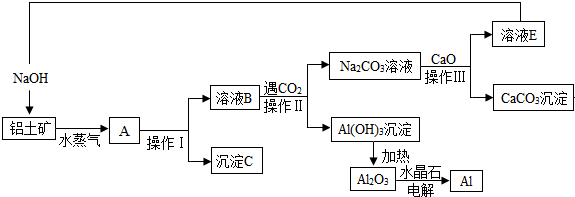
题目内容
4.工业上用含有Cr2O72-和CrO42-的废水回收铬.其工艺流程如下:
已知:①2CrO42-(黄色)+2H+═Cr2O72-(橙色)+H2O;
②常温下,KspFe(OH)3=1.0×10-38,Ksp Cr(OH)3=1.0×10-32;
③当离子浓度小于1.0×10-5 mol•L-1时,认为沉淀完全.
(1)下列选项中能说明反应2CrO42-(黄色)+2H+═Cr2O72-(橙色)+H2O达平衡状态的是CD (填选项字母).
A.Cr2O72-和CrO42-的浓度相同
B. 2v(Cr2O72-)=v(CrO42-)
C.溶液的颜色不变
D.溶液的PH不变
(2)为防止FeSO4溶液变质,在保存时需加入的试剂为铁粉、硫酸 (填试剂名称)
(3)过滤操作中需要用到的玻璃仪器有烧杯、漏斗、玻璃棒
(4)FeSO4溶液与溶液A发生反应的离子方程式为Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
(5)沉淀C的化学式为Fe(OH)3,pH2的范围为>5.
分析 含有Cr2O72-和CrO42-的废水经酸化后主要转化为Cr2O72-,Cr2O72-具有强氧化性,加入还原性的亚铁离子,将其还原为Cr3+,然后依据溶度积常数分别调节溶液的pH值,让铁离子和铬离子沉淀出来,
(1)根据判断平衡状态的方法:V正=V逆,或各组分的浓度保持不变则说明已达平衡;
(2)防止亚铁离子氧化,还要抑制亚铁离子水解,据此解答即可;
(3)过滤是分离固体与液体的一种方法,依据过滤需要仪器回答即可;
(4)亚铁离子具有还原性,铬酸根具有强氧化性,据此书写离子反应方程式即可;
(5)当离子浓度小于1.0×10-5 mol•L-1时,认为沉淀完全,据此解答即可.
解答 解:(1)平衡时各物质的浓度不再改变,即溶液的颜色不再改变和pH不变,
A.Cr2O72-和CrO42-的浓度相同和起始量消耗量有关,不能说明正逆反应速率相同,故A错误;
B. 2v(Cr2O72-)=v(CrO42-)只能说明速率之比等于化学方程式计量数之比,不能说明正逆反应速率相同,故B错误;
C.溶液的颜色不变 浓度不再改变,是平衡标志,正逆反应速率相同,故C正确;
D.溶液的PH不变,说明溶液这离子浓度不变,说明正逆反应速率相同,故D正确;
故选:CD,
故答案为:CD.
(2)防止亚铁离子氧化,并抑制水解,则配制FeSO4溶液时,需加入少量铁粉和稀硫酸,
故答案为:铁粉、硫酸;
(3)过滤是把不溶于液体的固体与液体分离的一种方法,所需仪器有玻璃棒、烧杯、铁架台、漏斗,其中属于玻璃仪器的是玻璃棒、烧杯、漏斗,
故答案为:烧杯、漏斗、玻璃棒;
(4)依据分析可知:溶液A含有Cr2O72-,具有强氧化性,能氧化亚铁离子为铁离子,离子反应方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,故答案为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;
(5)依据分析可知,沉淀C为氢氧化铁,当离子浓度小于1.0×10-5 mol•L-1时,认为沉淀完全,故铬离子完全沉淀时有:1×10-5×c(OH)3=1.0×10-32,解:c(OH)=$\root{3}{\frac{1.0×1{0}^{-32}}{1×1{0}^{-5}}}$=10-9,即pH>5完全沉淀,
故答案为:Fe(OH)3;>5
点评 本题主要考查的是金属的回收与资源利用,涉及氧化还原反应、化学反应平衡移动原理、离子反应方程式书写,常见实验操作以及仪器选择等,难度较大.

 阅读快车系列答案
阅读快车系列答案| A. | 把氯气通入FeCl2溶液中 | |
| B. | 把绿豆大的钾投入水中 | |
| C. | 把溴水滴加到KI淀粉溶液中 | |
| D. | 把一段打磨过的镁带放入少量冷水中 |
| A. | 所有的原子核都是由质子和中子组成的 | |
| B. | 原子的最外层电子数不超过8个 | |
| C. | 稀有气体原子的最外层电子数为2或8 | |
| D. | 原子的次外层电子数可能为8 |
| A. | CH4 | B. | SiH4 | C. | PH3 | D. | H2S |
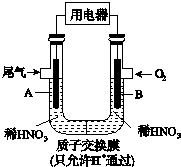 某研究小组构想将汽车尾气(NO、NO2)转化为重要的化工原料HNO3,其原理如图所示,其中A、B为多孔材料.下列说法正确的是( )
某研究小组构想将汽车尾气(NO、NO2)转化为重要的化工原料HNO3,其原理如图所示,其中A、B为多孔材料.下列说法正确的是( )| A. | 电解质溶液中电流的方向由B到A,电子的流向与之相反 | |
| B. | 电极A表面反应之一为NO-3e-+2H2O═NO${\;}_{3}^{-}$+4H+ | |
| C. | 电极B附近的c(NO${\;}_{3}^{-}$)增大 | |
| D. | 该电池工作时,每转移4 mol电子,消耗标准状况O222.4 L |
| A. | CH3CH2OH 和 CH3CH2CH2OH | B. | CH3CH2OH 和 CH3CHOH CH2CH3 | ||
| C. | CH3CH2OH 和 CH3OH | D. | CH3CH2CH2OH 和 CH3 (CH)3CHOH |
| A. | 水是一种很好的溶剂 | B. | 水在人体内没有调节体温的作用 | ||
| C. | 饮用水越纯净越好 | D. | 没有污染的水就是纯净水 |
| A. | CH3Br | B. | CH3CH2CH2CH2Br | ||
| C. | CH2BrCH2Br | D. | CH2BrCH2CH2CH2Br |