题目内容
在含有弱电解质的溶液中,往往有多个化学平衡共存。
(1)一定温度下,向1 L 0.1 mol·L-1CH3COOH溶液中加入0.1 mol CH3COONa固体,溶液中 (填“增大”、“减小”或“不变”);写出表示该混合溶液中所有离子浓度之间的一个等式 。
(填“增大”、“减小”或“不变”);写出表示该混合溶液中所有离子浓度之间的一个等式 。
(2)土壤的pH一般在4~9之间。土壤中Na2CO3含量较高时,pH可以高达10.5,试用离子方程式解释土壤呈碱性的原因 。加入石膏(CaSO4·2H2O)可以使土壤碱性降低,有关反应的化学方程式为 。
(3)常温下向20 mL 0.1 mol·L-1Na2CO3溶液中逐滴加入0.1 mol·L-1HCl溶液40 mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数随溶液pH变化的情况如下:
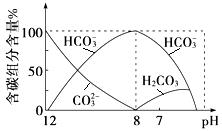
回答下列问题:
①在同一溶液中,H2CO3、HCO3-、CO32- (填“能”或“不能”)大量共存;
②当pH=7时,溶液中含碳元素的主要微粒有 、 ,溶液中含量最多的三种微粒的物质的量浓度的大小关系为 ;
(1)不变(1分) c(CH3COO-)+c(OH-)=c(H+)+c(Na+)(2分)
(2) CO32-+H2O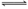 HCO3-+OH-(2分)
HCO3-+OH-(2分)
Na2CO3+CaSO4·2H2O===CaCO3+Na2SO4+2H2O或
Na2CO3+CaSO4===CaCO3+Na2SO4(2分)
(3)①不能(1分)
②HCO3-、H2CO3(2分) c(Na+)>c(Cl-)>c(HCO3-)(2分)

 名校课堂系列答案
名校课堂系列答案
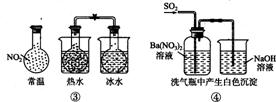
 △H<0 D.④中自色沉淀为BaS04
△H<0 D.④中自色沉淀为BaS04 )处于化学平衡状态,此时化学反应速率是
)处于化学平衡状态,此时化学反应速率是