题目内容
【题目】常温下,用pH=m的盐酸滴定20mLpH=n的MOH溶液,且m+n=14。混合溶液的pH与盐酸体积 (V)的关系如图所示。下列说法正确的是

A. Kb(MOH)的数量级为10-11 B. 由c点可算得m=![]()
C. a点:c(Cl-)>c(M+)>c(OH-)>(H+) D. b点溶液呈中性,此时c(Cl-)=c(M+)
【答案】D
【解析】常温下,用pH=m的盐酸滴定20mLpH=n 的MOH溶液,且m+n=14,则盐酸中氢离子浓度与MOH中氢氧根离子浓度相等,因为盐酸为强酸,且加入20mL 盐酸时溶液呈碱性,说明MOH为弱碱,则MOH的浓度大于盐酸;根据c点可知,盐酸和弱碱恰好完全反应,所以c(MOH)×20×10-3=10×40×10-3, c(MOH)=2×10-m mol/L;由于m+n=14,n-14=-m;所以当MOH达到电离平衡时,c(MOH)平衡 =2×10-m-10-m=10-m mol/L,电离平衡常数为 Kb(MOH)=c(OH-)×c(M+)/c(MOH) 平衡=10n-14×10n-14/10-m =10-m,由于pH=m是盐酸溶液,所以m小于7,即 Kb(MOH)的数量级大于10-11,A错误;c点溶液为MCl溶液,溶液的浓度为:![]() ×10-m =
×10-m =![]() ×10-m mol/L, 溶液水解显酸性,溶液pH=4,c(H+)=10-4 mol/L,由于水解过程微弱,所以10-m>10-4,m<4,不能为m=
×10-m mol/L, 溶液水解显酸性,溶液pH=4,c(H+)=10-4 mol/L,由于水解过程微弱,所以10-m>10-4,m<4,不能为m=![]() ,B错误;a点溶液为碱性,则,c(OH-)>c(H+)根据电荷守恒可以知道c(Cl-)<c(M+),溶液中正确的离子浓度大小为: c(M+)> c(Cl-)>c(OH-)>(H+) , C错误;b点溶液的pH=7,呈中性,则溶液中一定满足: c(H+)= c(OH-),根据电荷守恒:c(H+)+c(M+)=c(OH-)+c(Cl-),所以c(Cl-)=c(M+),D正确;正确选项 D。
,B错误;a点溶液为碱性,则,c(OH-)>c(H+)根据电荷守恒可以知道c(Cl-)<c(M+),溶液中正确的离子浓度大小为: c(M+)> c(Cl-)>c(OH-)>(H+) , C错误;b点溶液的pH=7,呈中性,则溶液中一定满足: c(H+)= c(OH-),根据电荷守恒:c(H+)+c(M+)=c(OH-)+c(Cl-),所以c(Cl-)=c(M+),D正确;正确选项 D。

【题目】碱式碳酸钴[Cox(OH)y(CO3)z]常用作电子材料,磁性材料的添加剂,受热时可分解生成三种氧化物。为了确定其组成,某化学兴趣小组同学设计了如图所示装置进行实验。
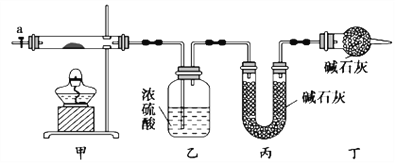
(1)请完成下列实验步骤:
①称取3.65g样品置于硬质玻璃管内,称量乙、丙装置的质量;
②按如图所示装置组装好仪器,并检验装置气密性;
③加热甲中玻璃管,当乙装置中____________(填实验现象),停止加热;
④打开活塞a,缓缓通入空气数分钟后,称量乙、丙装置的质量;
⑤计算。
(2)步骤④中缓缓通入空气数分钟的目的是_______________。
(3)某同学认为上述实验装置中存在一个明显缺陷,为解决这一问题,可选用下列装置中的_______(填字母)连接在__________(填装置连接位置)。
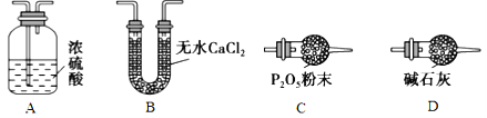
(4)若按正确装置进行实验,测得如下数据:则该碱式碳酸钴的化学式为______________。
乙装置的质量/g | 丙装置的质量/g | |
加热前 | 80.00 | 62.00 |
加热后 | 80.36 | 62.88 |
(5)CoCl2·6H2O常用作多彩水泥的添加剂,以含钴废料(含少量Fe、Al等杂质)制取CoCl2·6H2O的一种工艺如下:
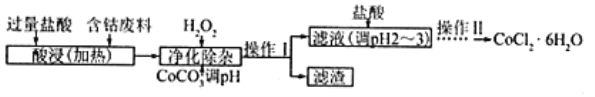
已知:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
开始沉淀(pH) | 2.3 | 7.5 | 7.6 | 3.4 |
完全沉淀(pH) | 4.1 | 9.7 | 9.2 | 5.2 |
①净除杂质时,加入H2O2发生反应的离子方程式为_____________。
②加入CoCO3调pH为5.2~7.6,则操作Ⅰ获得的滤渣成分为_____________________。
③加盐酸调整pH为2~3的目的为_________________。
④操作Ⅱ过程为_______________(填操作名称)、过滤。






