题目内容
【题目】CH4既是一种重要的能源,也是一种重要的化工原料。
(1)已知8.0 g CH4完全燃烧生成液体水放出444.8 kJ热量。则
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=____kJ·mol-1
(2)以CH4为燃料可设计成结构简单、能量转化率高、对环境无污染的燃料电池,其工作原理下图所示,则通入a气体的电极名称为 ,通入b气体的电极反应式为 。(质子交换膜只允许H+通过)

(3)在一定温度和催化剂作用下,CH4与CO2可直接转化成乙酸,这是实现“减排”的一种研究方向。
①在不同温度下,催化剂的催化效率与乙酸的生成速率如下图所示,则该反应的最佳温度应控制在 左右。

②该反应催化剂的有效成分为偏铝酸亚铜(CuAlO2,难溶物)。将CuAlO2溶解在稀硝酸中生成两种盐并放出NO气体,其离子方程式为 。
(4)CH4还原法是处理NOx气体的一种方法。已知一定条件下CH4与NOx反应转化为N2和CO2,若标准状况下8.96L CH4可处理22.4L NOx,则x值为 。
【答案】(1)-889.6 (2分)
(2) 负极 (1分) O2+4e-+4H+=2H2O (2分)
(3)①250℃ (1分) ②3CuAlO2+16H++NO3-=3Al3++3Cu2++NO↑+8H2O。 (2分)
(4)1.6 (2分)
【解析】
试题分析:(1)1mol甲烷的质量是16g,8g甲烷完全燃烧生成液体水放出444.8 kJ热量,则1mol甲烷完全燃烧生成液体水放出889.6kJ热量,故甲烷燃烧的热化学方程式是CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-889.6kJ·mol-1;(2)以CH4为燃料可设计成结构简单、能量转化率高、对环境无污染的燃料电池,根据图示可知通入a气体的电极是负极,通入b气体电极为正极,正极上氧气获得电子,与溶液的氢离子结合形成水,电极反应式为O2+4e-+4H+=2H2O。(3)①根据催化剂的催化效率及乙酸的产生速率与温度的关系图可知,在250℃催化剂的催化效率及乙酸的产生速率最高,故该反应的最佳温度应控制在250℃左右。②该反应催化剂的有效成分为偏铝酸亚铜(CuAlO2,难溶物)。将CuAlO2溶解在稀硝酸中生成两种盐并放出NO气体,根据电子守恒、电荷守恒及原子守恒,可得该反应的离子方程式为3CuAlO2+16H++NO3-=3Al3++3Cu2++NO↑+8H2O;(4)CH4还原法是处理NOx气体的一种方法。已知一定条件下CH4与NOx反应转化为N2和CO2,根据电子转移守恒,则:8.96L×[4-(-4)]=22.4L×2x,解得x=1.6。

【题目】研究小组用下图装置制取Cl2,证明产生的气体中含有HCl。
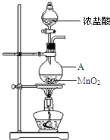
(1)仪器A的名称为_________;A中反应的离子方程式为______________________;
(2)甲同学将A中产生的气体通入下列溶液:
实验序号 | 试剂 | 现象 |
a | 紫色石蕊溶液 | ____________________________ |
b | AgNO3溶液 | 出现白色沉淀 |
①实验a中的现象为______________________;
②不能证明产生的气体中含有HCl的实验是______________(填字母序号);
(3)已知将HCl气体通入饱和食盐水中有白色固体析出.乙同学将A中产生的气体通入饱和食盐水中,有白色固体析出,但该实验不能证明气体中含有HCl,结合化学用语解释其原因______________;
(4)已知:2S2O32-+I2═S4O62-+2I-.丙同学将A中产生的气体通入蒸馏水中,得到溶液X,进行以下实验证明气体中含有HCl.
I.测定X中溶解的Cl2.取25.00mL溶液X,加入过量KI溶液,然后用0.04molL-1 Na2S2O3溶液滴定生成
的I2,达滴定终点时消耗Na2S2O3溶液V mL.
Ⅱ.测定X中Cl元素总量.另取25.00mL溶液X,选用适当的还原剂将溶解的Cl2全部还原为Cl-,再用0.10molL-1 AgNO3溶液滴定所得溶液中的Cl-.
①X中的HClO不会影响I的测定结果,原因是_________________________;
②由I、Ⅱ中实验数据可证明A中产生的气体中含有HCl,则Ⅱ中消耗0.10molL-1 AgNO3溶液的体积应大于____________________mL(用含V的代数式表示)。