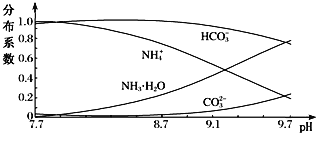
题目内容
【题目】某密闭容器中发生如下反应:2X(g)+Y(g) ![]() 2Z(g) △H<0,下图是表示该反应速率(v)随时间(t)变化的关系图。t1、t2、t5时刻外界条件均有改变(但都没有改变各物质的用量)。则下列说法中正确的是
2Z(g) △H<0,下图是表示该反应速率(v)随时间(t)变化的关系图。t1、t2、t5时刻外界条件均有改变(但都没有改变各物质的用量)。则下列说法中正确的是
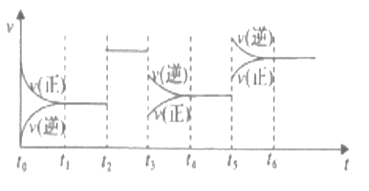
A. t6时刻后反应物的转化率最低 B. t5时增大了压强
C. t4时该反应的平衡常数小于t6时反应的平衡常数 D. t3时降低了温度
【答案】A
【解析】
由图可知,t2时改变条件,正逆反应速率均增大且相等,改变的条件应是使用催化剂;t3时改变条件,正逆反应速率均减小,且逆反应速率大于正反应速率,改变的条件应是减小压强;t5时改变条件,正逆反应速率均增大,且逆反应速率大于正反应速率,改变的条件应是升高温度;由图可知,t2平衡不移动,t3平衡逆向移动,t5平衡逆向移动,以此分析转化率变化。
A、当不改变反应物用量,平衡向逆反应方向移动,反应物的转化率降低,所以t6时刻后反应物的转化率最低,故A正确;
B、t5时正逆反应速率均增大,且逆反应速率大于正反应速率,改变的条件应是升高温度,故B错误;
C、t5时改变条件,正逆反应速率均增大,且逆反应速率大于正反应速率,改变的条件应是升高温度,平衡向逆反应方向移动,平衡常数减小,所以t4时该反应的平衡常数大于t6时反应的平衡常数,故C错误;
D、t3时改变条件,正逆反应速率均减小,且逆反应速率大于正反应速率,改变的条件是减小压强,故D错误。
故答案选A。

【题目】碱式碳酸铜可用作木材防腐剂、水体杀藻剂等,研究性学习小组设计以下方案制备碱式碳酸铜并进行相关实验探究。
Ι.以铜屑为原料制备碱式碳酸铜的装置如下:
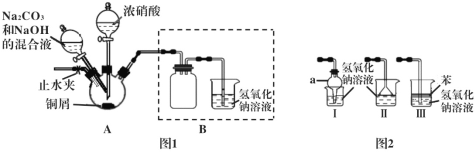
步骤1 连接好装置,检查装置的气密性,装药品。
步骤2 往三颈烧瓶中加入适量的浓硝酸,使铜屑完全反应。
步骤3 往步骤2反应后的溶液中加入一定比例的Na2CO3和NaOH的混合液,加热。
步骤4 将三颈烧瓶中的混合物过滤、洗涤、烘干,获得产物。
已知:ⅰ.碱式碳酸铜为草绿色或绿色结晶物,易溶于酸,不溶于水,在100℃的水中易分解;
ⅱ.NO+NO2+2NaOH=2NaNO2+H2O,2NO2+2NaOH=NaNO3+NaNO2+H2O;
NO不能单独与NaOH溶液反应。
(1)步骤2中浓硝酸与铜屑反应的离子方程式为___________________。
(2)步骤2反应一段时间后,须打开止水夹,通入一段时间的空气,目的是_______。
(3)步骤3对装置A的加热方式最好采用____________。
(4)装置Ι中仪器a的名称为____,Ⅰ、Ⅱ、Ⅲ三个装置不能替代图1中B装置的是_____(填装置序号)。
(5)欲检验步骤4获得的产物中是否含有NO3-,所需的试剂可以是__________。
Ⅱ.探究在一定温度下,不同的原料配比对产物的影响,实验数据如下:
实验序号 | V[Cu(NO3)2] /mL (0.5 mo1·L-1) | V(NaOH) / mL (0.5 mo1·L-1) | V(Na2CO3)/ mL (0.25 mo1·L-1) | 沉淀数量 | 沉淀颜色 |
1 | 2.0 | 2.0 | 1.6 | + | 浅绿色 |
2 | 2.0 | 2.0 | 2.0 | + + | 浅绿色 |
3 | 2.0 | 2.0 | 2.4 | + + + | 蓝色 |
4 | 2.0 | 2.0 | 2.8 | + + + | 蓝色 |
注:“+”越多表示沉淀量越多
(6)分析表格数据可得:制备碱式碳酸铜最佳的原料配比n[Cu(NO3)2]:n(NaOH) : n(Na2CO3) =___。
Ⅲ.产物组成的测定
(7)碱式碳酸铜的成分有多种,化学式可表示为mCu(OH)2·n CuCO3。为测定Ι中所得碱式碳酸铜的组成,学习小组同学准确称取3.820 g样品溶于适量的硫酸中,加水配成l00 mL溶液,取l0.00 mL溶液于锥形瓶中,加适量水稀释,调节溶液pH至3~4,加入过量的KI(2 Cu2+ + 4 I- = 2 CuI↓ + I2),用0.l000 mol·L-1 Na2S2O3标准溶液滴定(2 S2O32- + I2 = 2I- + S4O62-),接近终点时,加入淀粉指示剂,继续滴定至终点,蓝色消失。进行平行实验后,测得平均消耗Na2S2O3标准溶液的体积为35.00 mL。该碱式碳酸铜的化学式为_____