题目内容
【题目】25℃时,NaCN溶液中CN-、HCN浓度所占分数(![]() )随pH变化的关系如图甲所示,其中a点的坐标为(9.5,0.5)。向10mL0.01mol·L-1NaCN溶液中逐滴加入0.01mol·L-1的盐酸,其pH变化曲线如图乙所示。下列溶液中的关系中一定正确的
)随pH变化的关系如图甲所示,其中a点的坐标为(9.5,0.5)。向10mL0.01mol·L-1NaCN溶液中逐滴加入0.01mol·L-1的盐酸,其pH变化曲线如图乙所示。下列溶液中的关系中一定正确的
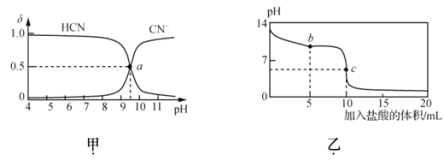
A.图甲中pH=7的溶液:c(Cl-)=c(HCN)
B.常温下,NaCN的水解平衡常数:Kh(NaCN)=10-4.5mol/L
C.图乙中b点的溶液:c(CN-)>c(Cl-)>c(HCN)>c(OH-)>c(H+)
D.图乙中c点的溶液:c(Na+)+ c(H+)= c(HCN)+ c(OH-)+ c(CN-)
【答案】B
【解析】
A. 图甲中可以加入HCN调节溶液的pH=7,溶液中不一定存在Cl-,即不一定存在c(Cl-)=c(HCN),故A错误;
B. a点的坐标为(9.5,0.5),此时c(HCN)=c(CN),HCN的电离平衡常数为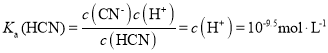 ,则NaCN的水解平衡常数
,则NaCN的水解平衡常数![]() ,故B正确;
,故B正确;
C. b点加入5mL盐酸,反应后溶液组成为等浓度的NaCN、HCN和NaCl,由图乙可知此时溶液呈碱性,则HCN的电离程度小于CN的水解程度,因此c(HCN)>c(CN),故C错误;
D. c点加入10mL盐酸,反应后得到等浓度的HCN和NaCl的混合溶液,任何电解质溶液中都存在电荷守恒和物料守恒,根据物料守恒得c(Cl)=c(HCN)+c(CN),而根据电荷守恒可知,c(Na+)+ c(H+)= c(Cl)+ c(OH)+ c(CN),则c(Na+)+ c(H+)= c(HCN)+ c(OH-)+ 2c(CN-),故D错误;
故选B。

 春雨教育同步作文系列答案
春雨教育同步作文系列答案【题目】SO2是一种重要的氧化物,可用于生产三氧化硫、硫酸、亚硫酸盐、硫代硫酸盐,也可用作熏蒸剂、防腐剂、消毒剂、还原剂等。
(1)SO2性质多变,若将SO2气体通入氢硫酸中,能看到的现象为:__________,该反应中SO2表现出______性;若将SO2气体通入酸性高锰酸钾溶液中,离子反应方程式为_________,该反应中SO2表现出__________性。
(2)SO2有毒,且能形成酸雨,是大气主要污染物之一。石灰-石膏法和碱法是常用的烟气脱硫法。石灰-石膏法的吸收原理:①SO2+Ca(OH)2=CaSO3↓+H2O②2CaSO3+O2+4H2O=2CaSO4·2H2O碱法的吸收原理:将含SO2的尾气通入足量的烧碱溶液中,请写出对应的化学反应方程式__________;
已知:
试剂 | Ca(OH)2 | NaOH |
价格(元/kg) | 0.36 | 2.9 |
余石灰-石膏法相比,碱法的优点是吸收快、效率高,缺点是__________;
(3)在石灰-石膏法和碱法的基础上,设计了双碱法,能实现物料循环利用。

上述方法中,实现循环利用的物质是__________,请用化学方程式表示在Na2SO3溶液中加入CaO后的反应原理__________。







