题目内容
【题目】SO2是一种重要的氧化物,可用于生产三氧化硫、硫酸、亚硫酸盐、硫代硫酸盐,也可用作熏蒸剂、防腐剂、消毒剂、还原剂等。
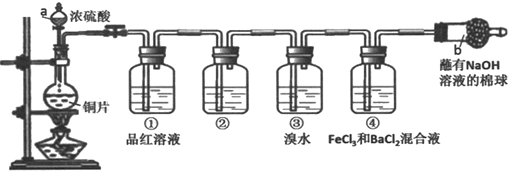
(1)SO2性质多变,若将SO2气体通入氢硫酸中,能看到的现象为:__________,该反应中SO2表现出______性;若将SO2气体通入酸性高锰酸钾溶液中,离子反应方程式为_________,该反应中SO2表现出__________性。
(2)SO2有毒,且能形成酸雨,是大气主要污染物之一。石灰-石膏法和碱法是常用的烟气脱硫法。石灰-石膏法的吸收原理:①SO2+Ca(OH)2=CaSO3↓+H2O②2CaSO3+O2+4H2O=2CaSO4·2H2O碱法的吸收原理:将含SO2的尾气通入足量的烧碱溶液中,请写出对应的化学反应方程式__________;
已知:
试剂 | Ca(OH)2 | NaOH |
价格(元/kg) | 0.36 | 2.9 |
余石灰-石膏法相比,碱法的优点是吸收快、效率高,缺点是__________;
(3)在石灰-石膏法和碱法的基础上,设计了双碱法,能实现物料循环利用。

上述方法中,实现循环利用的物质是__________,请用化学方程式表示在Na2SO3溶液中加入CaO后的反应原理__________。
【答案】溶液中生成黄色沉淀 氧化性 2MnO4-+5SO2+2H2O=5SO42-+2Mn2++4H+ 还原性 SO2+2NaOH=Na2SO3+H2O 成本较高 NaOH CaO+H2O=Ca(OH)2 Ca(OH)2+Na2SO3=CaSO3↓+2NaOH
【解析】
(1)将SO2气体通入氢硫酸中,发生反应SO2+2H2S=3S↓+2H2O;将SO2气体通入酸性高锰酸钾溶液中,发生反应:5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+;
(2)二氧化硫和氢氧化钠的反应方程式为:2NaOH+SO2=Na2SO3+H2O,参照价格表,NaOH成本高;
(3)向Na2SO3溶液中加入CaO后,生成NaOH,故NaOH为循环利用的物质;CaO加入溶液中会先和水反应,即CaO+H2O=Ca(OH)2,生成的Ca(OH)2再和Na2SO3溶液反应,据此答题。
(1)二氧化硫具有弱氧化性,将SO2气体通入氢硫酸中,发生反应SO2+2H2S=3S↓+2H2O,
看到的现象为溶液中生成黄色沉淀,二氧化硫中S化合价由+4价→0价,化合价降低的反应物作氧化剂,体现氧化性;将SO2气体通入酸性高锰酸钾溶液中,高锰酸钾具有强氧化性,将二氧化硫溶于水后生成的亚硫酸氧化为硫酸,二氧化硫遇到强氧化剂时体现还原性,将MnO4-还原为Mn2+,S元素的化合价升高2价,锰元素的化合价降低5价,则高锰酸根系数为2,二氧化硫系数为5,根据原子守恒,硫酸根系数为5,Mn2+系数为2,根据电荷守恒,右侧补4个氢原子,最终根据H原子守恒,左侧补2个水,即方程式为:
5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+,二氧化硫中S元素的化合价由+4价→+6价,化合价升高的反应物作还原剂,体现还原性,故答案为:溶液中生成黄色沉淀,氧化性,2MnO4-+5SO2+2H2O=5SO42-+2Mn2++4H+,还原性。
(2)二氧化硫作为酸性氧化物,可以和氢氧化钠反应盐和水,参照二氧化碳和氢氧化钠反应的方程式,写出二氧化硫和氢氧化钠的反应方程式为:2NaOH+SO2=Na2SO3+H2O,由于石灰的碱性比氢氧化钠弱,吸收SO2的速率慢、效率低,但吸收成本比氢氧化钠低的多,故答案为:SO2+2NaOH=Na2SO3+H2O,成本较高。
(3)从流程图中可以看出,向Na2SO3溶液中加入CaO后,生成NaOH,生成的NaOH可以作为二氧化硫的吸收剂,故NaOH为循环利用的物质;CaO加入溶液中会先和水反应,即CaO+H2O=Ca(OH)2,生成的Ca(OH)2再和Na2SO3溶液反应,根据流程图,反应物之一为NaOH,再根据复分解反应原理,另一生成物为CaSO3,故反应方程式为:Ca(OH)2+Na2SO3=CaSO3↓+2NaOH,故答案为:NaOH,CaO+H2O=Ca(OH)2、Ca(OH)2+Na2SO3=CaSO3↓+2NaOH。

【题目】用某废催化剂(主要成分Al2O3、K2O、少量CoO、SiO2等)来制取明矾的工艺流程如下图所示,回答下列问题:

(1)废催化剂在浸取前进行球磨的主要目的是________________________________________。
(2)浸取时Al2O3溶解的化学方程式为________________________________________;
(3)滤渣的主要成分是_________________ (填化学式)。
(4)实验测得K2CO3的加入量与KA1(SO4)2·12H2O产率及纯度关系如下表所示:
编号 | 1 | 2 | 3 | 4 |
K2CO3加入量/g | 2 | 4 | 6 | 8 |
产品质量/g | 3.3 | 5.7 | 4.6 | 4.5 |
明矾纯度/g | 99.1 | 98.2 | 91.4 | 84.9 |
当K2CO3的加入量超过4 g后,晶体的质量减少且纯度降低,其原因是________________________。