题目内容
A、B、C、D、E五种短周期元素的原子序数依次增大。元素A的负一价离子具有和稀有气体He一样的结构,元素B的最外层电子数是内层电子总数的2倍,元素C是短周期元素中原子半径最大的主族元素,元素D在地壳中的含量位于第二位,元素E与元素B可形成具有正四面体结构的物质。请回答下列问题:
(1)在周期表中,元素B位于第 周期第 族;A与C形成的离子化合物的化学式为 _________________ ; A与C形成的离子化合物与水反应的化学方程式为 。
(2)C形成的简单离子的离子结构示意图为 。
(3)D、E元素形成的化合物可与水反应生成一种沉淀和一种气体,试写出该反应的化学方程式: ___________ 。
(4)单质B与水反应是将B充分利用的措施之一,试写出该反应的化学方程式: ______________________________________ 。
(1)在周期表中,元素B位于第 周期第 族;A与C形成的离子化合物的化学式为 _________________ ; A与C形成的离子化合物与水反应的化学方程式为 。
(2)C形成的简单离子的离子结构示意图为 。
(3)D、E元素形成的化合物可与水反应生成一种沉淀和一种气体,试写出该反应的化学方程式: ___________ 。
(4)单质B与水反应是将B充分利用的措施之一,试写出该反应的化学方程式: ______________________________________ 。
(1)二 ⅣA NaH NaH+H2O=NaOH+H2↑
(2)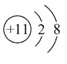
(3)SiCl4+3H2O=H2SiO3↓+4HCl↑
(4)C+H2O(g)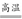 CO+H2
CO+H2
(2)
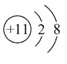
(3)SiCl4+3H2O=H2SiO3↓+4HCl↑
(4)C+H2O(g)
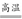 CO+H2
CO+H2元素A的负一价离子具有和稀有气体He一样的结构,A为H;元素B的最外层电子数是内层电子总数的2倍,B为碳元素;元素C是短周期元素中原子半径最大的主族元素,C为钠元素;元素D在地壳中的含量位于第二位,D为硅元素;元素E与元素B可形成具有正四面体结构的物质,E为氯元素。
(1)碳元素在周期表中的位置为第二周期第ⅣA族,H与Na形成的离子化合物化学式为NaH,NaH与水反应的化学方程式为NaH+H2O=NaOH+H2↑。
(2)Na+的离子结构示意图为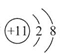
(3)Si与Cl元素形成的化合物为SiCl4,与水反应的化学方程式为SiCl4+3H2O=H2SiO3↓+4HCl↑。
(4)碳与水蒸气的反应为C+H2O(g) CO+H2。
CO+H2。
(1)碳元素在周期表中的位置为第二周期第ⅣA族,H与Na形成的离子化合物化学式为NaH,NaH与水反应的化学方程式为NaH+H2O=NaOH+H2↑。
(2)Na+的离子结构示意图为
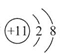
(3)Si与Cl元素形成的化合物为SiCl4,与水反应的化学方程式为SiCl4+3H2O=H2SiO3↓+4HCl↑。
(4)碳与水蒸气的反应为C+H2O(g)
 CO+H2。
CO+H2。
练习册系列答案
相关题目

 >K2-
>K2-