题目内容
5.如表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,W元素原子的核电荷数为X元素的2倍.下列说法正确的是( )| X | ||
| Y | Z | W |
| T |
| A. | X、W、Z元素的原子半径及它们的气态氢化物的热稳定性均依次递增 | |
| B. | Y、Z、W元素在自然界中均不能以游离态存在,它们的最高价氧化物的水化物的酸性依次递增 | |
| C. | YX2晶体熔化、液态WX3气化均需克服分子间作用力 | |
| D. | 根据元素周期律,可以推测T元素的单质具有半导体特性,T2X3具有氧化性和还原性 |
分析 X、Y、Z、W为短周期元素,由元素周期表可知:X应位于第二周期,且应处于周期表中右半部分,W与X处于同一主族,且W元素原子的核电荷数为X元素的2倍,那么X为O,W为S,据此结合选项判断即可.
解答 解:X、Y、Z、W为短周期元素,由元素周期表可知:X应位于第二周期,且应处于周期表中右半部分,W与X处于同一主族,且W元素原子的核电荷数为X元素的2倍,那么X为O,W为S,那么Z为P,T为As,Y为Si,
A、元素的非金属性越强,其气态氢化物越稳定,由于非金属性O>S>P,故H2O>H2S>H3P,故A错误;
B、S元素在自然界中存在游离态单质,常在火山口附近,故B错误;
C、YX2为SiO2,属于原子晶体,该固体熔化克服的是共价键,没有分子间作用力,故C错误;
D、As处于元素周期表的金属与非金属分界线上,具有半导体的性能,T2X3为As2O3,As的化合价为+3,处于中间价,故既有氧化性也有还原性,故D正确,
故选D.
点评 本题考查元素的位置与性质、结构的关系,难度不大,解题是时注意元素的性质的递变规律及其应用.

练习册系列答案
 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案
相关题目
20.某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )
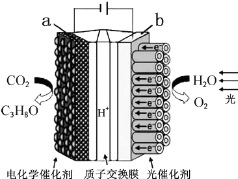

| A. | 该装置将化学能转化为光能和电能 | |
| B. | 该装置工作时,H+从b极区向a极区迁移 | |
| C. | 每生成1mol O2,有44g CO2被还原 | |
| D. | a电极的反应为:3CO2+18H+-18e-=C3H8O+5H2O |
17.下列由实验现象得出的结论正确的是( )
| 操作及现象 | 结论 | |
| A | 向AgCl悬浊液中加入NaI溶液时出现黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |
| B | 向某溶液中滴加氯水后再加入KSCN溶液,溶液呈红色 | 溶液中一定含有Fe2+ |
| C | 向NaBr溶液中滴入少量氯水和苯,振荡、静置,溶液上层呈橙红色 | Br-还原性强于Cl- |
| D | 加热盛有NH4Cl固体的试管,试管底部固体消失,试管口有晶体凝结 | NH4Cl固体可以升华 |
| A. | A | B. | B | C. | C | D. | D |

 .
. .
.
 .
. .
. B.
B.
 .
.
