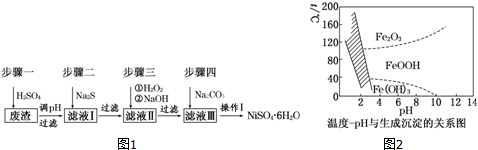
题目内容
20.某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )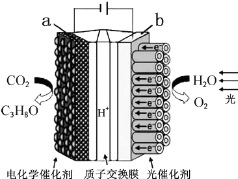
| A. | 该装置将化学能转化为光能和电能 | |
| B. | 该装置工作时,H+从b极区向a极区迁移 | |
| C. | 每生成1mol O2,有44g CO2被还原 | |
| D. | a电极的反应为:3CO2+18H+-18e-=C3H8O+5H2O |
分析 A、该装置是电解池装置,是将电能转化为化学能;
B、与电源正极相连的是电解池的阳极,负极相连的是电解池的阴极,a与电源负极相连,所以a是阴极,而电解池中氢离子向阴极移动;
C、电池总的方程式为:6CO2+8H2O$\frac{\underline{\;电解\;}}{\;}$2C3H8O+9O2,即生成9mol的氧气,阴极有6mol的二氧化碳被还原,由此分析解答;
D、a与电源负极相连,所以a是负极阴极,电极反应式为:3CO2+18H++18e-=C3H8O+5H2O.
解答 解:A、该装置是电解池装置,是将电能转化为化学能,所以该装置将光能和电能转化为化学能,故A错误;
B、a与电源负极相连,所以a是阴极,而电解池中氢离子向阴极移动,所以H+从阳极b极区向阴极a极区迁移,故B正确;
C、电池总的方程式为:6CO2+8H2O$\frac{\underline{\;电解\;}}{\;}$2C3H8O+9O2,即生成9mol的氧气,阴极有6mol的二氧化碳被还原,也就是1mol的氧气,阴极有$\frac{2}{3}$mol的二氧化碳被还原,所以被还原的二氧化碳为29.3g,故C错误;
D、a与电源负极相连,所以a是阴极,发生还原反应,电极反应式为:3CO2+18H++18e-=C3H8O+5H2O,故D错误;
故选B.
点评 本题考查电化学的相关知识,学生要清楚电解池的反应原理,阴极发生还原反应,阳极发生氧化反应,以及离子的移动方向就可以迅速解题了,比较容易.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
10.个体小煤矿经常发生瓦斯爆炸事故,造成多人伤亡,因此在矿井中,必须采取安全措施,如通风、严禁烟火等,而且要随时检查瓦斯的体积分数,如果空气中含甲烷5%~15%,运到明火会发生爆炸,发生最强烈爆炸时空气中甲烷所占的体积分数是( )
| A. | 5% | B. | 9.1% | C. | 10.5% | D. | 15% |
11.最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程.反应过程的示意图如下:

下列说法正确的是( )

下列说法正确的是( )
| A. | CO和O生成CO2是吸热反应 | |
| B. | 在该过程中,CO断键形成C和O | |
| C. | CO和O生成了具有极性共价键的CO2 | |
| D. | 状态Ⅰ→状态Ⅲ表示CO与O2反应的过程 |
8.下列说法正确的是( )
| A. | 稀醋酸中加入少量醋酸钠能增大醋酸的电离程度 | |
| B. | 25℃时,等体积等浓度的硝酸与氨水混合后,溶液pH=7 | |
| C. | 25℃时,0.1mol•L-1的硫化氢溶液比等浓度的硫化钠溶液的导电能力弱 | |
| D. | 0.1mol AgCl和0.1molAgI混合后加入1L水中,所得溶液中c(Cl-)=c(I-) |
5.如表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,W元素原子的核电荷数为X元素的2倍.下列说法正确的是( )
| X | ||
| Y | Z | W |
| T |
| A. | X、W、Z元素的原子半径及它们的气态氢化物的热稳定性均依次递增 | |
| B. | Y、Z、W元素在自然界中均不能以游离态存在,它们的最高价氧化物的水化物的酸性依次递增 | |
| C. | YX2晶体熔化、液态WX3气化均需克服分子间作用力 | |
| D. | 根据元素周期律,可以推测T元素的单质具有半导体特性,T2X3具有氧化性和还原性 |
12.某学习小组按如下实验流程探究海带中碘含量的测定和碘的制取.
实验(一) 碘含量的测定

取0.0100mol•L-1的AgNO3标准溶液装入滴定管,取100.00mL海带浸取原液至滴定池,用电势滴定法测定碘含量.测得的电动势(E) 反映溶液中c(I-)的变化,部分数据如表:
实验(二) 碘的制取
另制海带浸取原液,甲、乙两种实验方案如下:

已知:3I2+6NaOH═5NaI+NaIO3+3H2O
请回答:
(1)实验(一)中的仪器名称:仪器A坩埚,仪器B500mL容量瓶.
(2)①根据表中数据绘制滴定曲线:

②该次滴定终点时用去AgNO3溶液的体积为20.00mL,计算得海带中碘的百分含量为0.635%%.
(3)①分液漏斗使用前须检漏,检漏方法为向分液漏斗中加入少量蒸馏水,检查旋塞处是否漏水,将漏斗倒转过来,检查玻璃塞是否漏水.
②步骤X中,萃取后分液漏斗内观察到的现象是液体分为上下两层,下层呈紫红色.
③下列有关步骤Y的说法,正确的是AB.
A.应控制NaOH溶液的浓度和体积
B.将碘转化成离子进入水层
C.主要是除去海带浸取原液中的有机杂质
D.NaOH溶液可以由乙醇代替
④实验(二) 中操作Z的名称是过滤.
(4)方案甲中采用蒸馏不合理,理由是碘单质易升华,会导致碘损失.
实验(一) 碘含量的测定

取0.0100mol•L-1的AgNO3标准溶液装入滴定管,取100.00mL海带浸取原液至滴定池,用电势滴定法测定碘含量.测得的电动势(E) 反映溶液中c(I-)的变化,部分数据如表:
| V(AgNO3)/mL | 15.00 | 19.00 | 19.80 | 19.98 | 20.00 | 20.02 | 21.00 | 23.00 | 25.00 |
| E/mV | -225 | -200 | -150 | -100 | 50.0 | 175 | 275 | 300 | 325 |
另制海带浸取原液,甲、乙两种实验方案如下:

已知:3I2+6NaOH═5NaI+NaIO3+3H2O
请回答:
(1)实验(一)中的仪器名称:仪器A坩埚,仪器B500mL容量瓶.
(2)①根据表中数据绘制滴定曲线:

②该次滴定终点时用去AgNO3溶液的体积为20.00mL,计算得海带中碘的百分含量为0.635%%.
(3)①分液漏斗使用前须检漏,检漏方法为向分液漏斗中加入少量蒸馏水,检查旋塞处是否漏水,将漏斗倒转过来,检查玻璃塞是否漏水.
②步骤X中,萃取后分液漏斗内观察到的现象是液体分为上下两层,下层呈紫红色.
③下列有关步骤Y的说法,正确的是AB.
A.应控制NaOH溶液的浓度和体积
B.将碘转化成离子进入水层
C.主要是除去海带浸取原液中的有机杂质
D.NaOH溶液可以由乙醇代替
④实验(二) 中操作Z的名称是过滤.
(4)方案甲中采用蒸馏不合理,理由是碘单质易升华,会导致碘损失.
7. O3氧化海水中I-是大气中碘的主要来源.将O3通入稀硫酸酸化的NaI溶液中进行模拟研究,发生反应如下:
O3氧化海水中I-是大气中碘的主要来源.将O3通入稀硫酸酸化的NaI溶液中进行模拟研究,发生反应如下:
反应Ⅰ:O3+2I-+2H+=I2+O2+H2O
(1)用双线桥标示反应Ⅰ的电子转移情况 .
.
(2)I2可以继续与I-发生反应Ⅱ:I2(aq)+I-(aq)?I3-(aq)△H,为探究外在条件对I3-生成速率的影响,做了如下三组实验,完成表中的内容(表中不要留空格):
(3)用离子色谱仪测定I3-浓度随时间变化如图所示:
①反应Ⅱ的△H<0(填“>”“<”或“=”)
②实验B 10s内,I3-的生成速率为8.8×10-4mol/(L.s).
③实验B 18s后,I3-生成速率降低的主要原因是I-浓度降低.
(4)为进一步探究FeCl2对I3-生成速率的影响,提出合理假设,
假设一:Fe2+对反应起催化作用;
假设二:Cl-对反应起催化作用.
(5)请你设计实验验证上述假设一,写出实验步骤及结论.
实验步骤及结论:取一定量NaI溶液,加入稀硫酸调节pH=5.2,将溶液均分为两份A和B,向A、B试管中分解加入等物质的量的FeSO4、Na2SO4固体少许,之后同时向两支试管中通入O3,用离子色谱仪测定10s后I3-浓度,若cA(I3-)>cB(I3-),说明假设一成立,若cA(I3-)=cB(I3-),则假设一不成立.
 O3氧化海水中I-是大气中碘的主要来源.将O3通入稀硫酸酸化的NaI溶液中进行模拟研究,发生反应如下:
O3氧化海水中I-是大气中碘的主要来源.将O3通入稀硫酸酸化的NaI溶液中进行模拟研究,发生反应如下:反应Ⅰ:O3+2I-+2H+=I2+O2+H2O
(1)用双线桥标示反应Ⅰ的电子转移情况
 .
.(2)I2可以继续与I-发生反应Ⅱ:I2(aq)+I-(aq)?I3-(aq)△H,为探究外在条件对I3-生成速率的影响,做了如下三组实验,完成表中的内容(表中不要留空格):
| 实验编号 | 实验目的 | 反应物 | 温度 | 反应前溶液的pH |
| A | 对照组 | O3+NaI+H2SO4 | 25℃ | 5.2 |
| B | 研究FeCl2对I3-生成速率的影响 | O3+NaI+H2SO4+FeCl2 | 25℃ | 5.2 |
| C | 研究温度对I3-生成速率的影响 | O3+NaI+H2SO4 | 5℃ | 5.2 |
①反应Ⅱ的△H<0(填“>”“<”或“=”)
②实验B 10s内,I3-的生成速率为8.8×10-4mol/(L.s).
③实验B 18s后,I3-生成速率降低的主要原因是I-浓度降低.
(4)为进一步探究FeCl2对I3-生成速率的影响,提出合理假设,
假设一:Fe2+对反应起催化作用;
假设二:Cl-对反应起催化作用.
(5)请你设计实验验证上述假设一,写出实验步骤及结论.
实验步骤及结论:取一定量NaI溶液,加入稀硫酸调节pH=5.2,将溶液均分为两份A和B,向A、B试管中分解加入等物质的量的FeSO4、Na2SO4固体少许,之后同时向两支试管中通入O3,用离子色谱仪测定10s后I3-浓度,若cA(I3-)>cB(I3-),说明假设一成立,若cA(I3-)=cB(I3-),则假设一不成立.

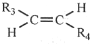 ,则T的结构简式为
,则T的结构简式为 .
.