题目内容
【题目】甲烷是重要的气体燃料和化工原料。回答下列问题:
(1)已知CH4、CO、H2的燃烧热分别为akJ/mol、bkJ/mol、ckJ/mol。18g液态水转化为气态水吸热dkJ/mol。利用甲烷制备合成气的化学方程式CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH。
CO(g)+3H2(g) ΔH。
①ΔH=__kJ/mol。
②一定温度下,在恒容的密闭容器中发生上述反应,下列表示反应达到平衡状态的有___(填字母)。
A.v正(CH4)=v逆(H2O)
B.气体压强不再变化
C.单位时间每消耗1molCH4,同时产生3molH2
D.CH4与H2的物质的量之比为1∶3
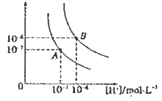
(2)在某密闭容器中通入2molCH4和2molH2O(g),在不同条件下发生反应CH4(g)+H2O(g)CO(g)+3H2(g),测得平衡时CH4的体积分数与温度、压强的关系如图所示。

①p1___p2(填“<”、“>”或“=”),该反应为___(填吸或放)热反应。
②m、n、q三点的化学平衡常数大小关系为__。
③若q点对应的纵坐标为30,此时甲烷的转化率为___,该条件下的化学平衡常数Kp=___(用含有P1的表达式表示,Kp为以分压表示的平衡常数)。
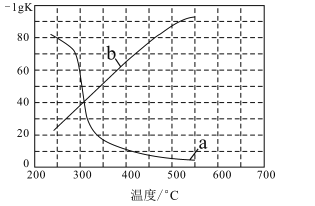
(3)实验测定该反应的化学平衡常数Kp随温度变化的曲线是如图中的___(填a、b),理由是___。
【答案】(b+3c-a-d) AB > 吸 Km<Kn<Kq 25% 0.03P12 a 正反应为吸热反应,升高温度,平衡常数增大,负对数减小,曲线a满足
【解析】
(1)①依题意分别写出燃烧热化学反应方程式,利用盖斯定律解答;
②依据可逆反应处于平衡状态的判断方法分析;
(2)①CH4(g)+H2O(g)CO(g)+3H2(g),正反应是体积增大的反应,结合图像分析在压强不变的情况下升高温度,CH4体积分数减小,根据勒夏特列原理分析;
②化学平衡常数只受温度影响,结合图示各点的温度大小和反应的移动方向判断平衡常数大小关系;
③根据题意和图像结合三段式解答计算;
(3)正反应为吸热反应,分析温度对平衡移动的影响。
(1)①CH4、CO、H2的燃烧热分别为akJ/mol、bkJ/mol、ckJ/mol。18g液态水转化为气态水吸热dkJ/mol。
可得:①CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H1=-akJ/mol;
②CO(g)+![]() O2(g)=CO2(g) △H2=- bkJ/mol;
O2(g)=CO2(g) △H2=- bkJ/mol;
③H2(g)+![]() O2(g)=H2O(l) △H3=-ckJ/mol;
O2(g)=H2O(l) △H3=-ckJ/mol;
④H2O(l)=H2O(g) △H4=+dkJ/mol;
根据盖斯定律:①-②-③×3-④可得CH4(g)+H2O(g)CO(g)+3H2(g) △H=(b+3c-a-d) kJ/mol;
②A.v正(CH4)=v逆(H2O),等式中有正反应速率,逆反应速率,且成系数比,可说明正逆反应速率相等,反应达到平衡状态,故A正确;
B.气体压强不再变化,即气体分子数不变,可以判断平衡状态,故B正确;
C.单位时间每消耗1molCH4,同时产生3molH2是相同的反应方向,不能判断平衡状态,故C错误;
D.CH4与H2的物质的量之比为1∶3不能说明物质的量及物质的量浓度不变,无法判断平衡状态,故D错误;
答案选AB;
(2)①CH4(g)+H2O(g)CO(g)+3H2(g),正反应是气体体积增大的反应,增大压强平衡逆向移动,甲烷的体积分数增多,故p1>p2;结合图像分析可知,在压强不变的情况下升高温度,CH4体积分数减小,说明平衡正向移动,故该反应为吸热反应;
②化学平衡常数只受温度影响,正反应吸热,升高温度,K增大,故Km<Kn<Kq;
③若q点对应的纵坐标为30,说明甲烷的体积分数为30%,根据“三段式”:

则![]() =30%,可得x=0.5,故甲烷的转化率=
=30%,可得x=0.5,故甲烷的转化率=![]() ×100%=25%,相同条件下,物质的量之比等于压强之比,该条件下的化学平衡常数Kp=
×100%=25%,相同条件下,物质的量之比等于压强之比,该条件下的化学平衡常数Kp= =0.03
=0.03![]() 2;
2;
(3)正反应为吸热反应,升高温度,平衡常数增大,负对数减小,曲线a满足。

 阅读快车系列答案
阅读快车系列答案