题目内容
(12分)(1)蕴藏在海底的“可燃冰”是高压下形成的外观像冰的甲烷水合物固体(分子式为CH4·9H2O),则356g“可燃冰”释放出的甲烷燃烧,生成液态水时能放出1780.6 kJ的热量,则甲烷燃烧的热化学方程式可表示为:_______________________________。
(2) 在100℃时,将0.100mol的N2O4气体充入1 L恒容抽空的密闭容器中,隔一定时间对该容器内物质的浓度进行分析得到下表数据: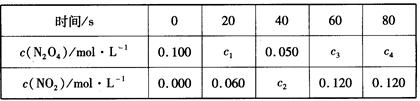
①从表中分析:该反应的平衡常数为___________;
②在上述条件下,60s内N2O4的平均反应速率为_____________;
③达平衡后下列条件的改变可使NO2浓度增大的是_________。
| A.增大容器的容积 | B.再充入一定量的N2O4 |
| C.再充入一定量的NO2 | D.再充入一定量的He |
②用等浓度的盐酸分别中和等体积浓度均为0.01mol/L的氨水和NaOH溶液,消耗盐酸的体积分别为V3、V4,则V3_____V4;
③用等浓度的盐酸分别和等体积浓度均为0.01mol/L的氨水和NaOH溶液反应,最后溶液均为中性,消耗盐酸的体积分别为V5、V6,则V5_____V6。
(1)CH4(g) +2O2 (g)→CO2(g)+2H2O(l);△H="-890.3" kJ/mol;
(2) ①0.36; ②0.001 mol/(L·s); ③B、C; (3)>; =; <。
解析试题分析:(1)356g“可燃冰”的物质的量是356g÷178g/mol=2mol。则其中含有的甲烷的物质的量是2mol,能放出1780.6 kJ的热量,则1mol的甲烷完全燃烧产生稳定的化合物时所放出的热量是1780.6 kJ÷2mol=890.3 kJ.甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)→CO2(g)+2H2O(l);△H=-890.3 kJ/mol; (2) ①从表中分析:该反应达到平衡时N2O4的平衡浓度是0.04mol/L、NO2平衡浓度是0.12mol/L,则反应的平衡常数为K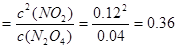 ;②在上述条件下,60s内N2O4的平均反应速率为v(N2O4)=
;②在上述条件下,60s内N2O4的平均反应速率为v(N2O4)=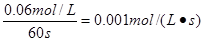 ; ③A.增大容器的容积,NO2浓度减小,错误;B.再充入一定量的N2O4,即增大反应物的浓度,平衡正向移动,NO2浓度增大,正确;C.再充入一定量的NO2,平衡逆向移动,但是平衡移动消耗量远小于加入量,所以NO2浓度增大,正确;D.再充入一定量的He,对平衡无影响,NO2浓度不变,错误。(3)因为一水合氨是弱碱,NaOH是强碱,所以常温下①用等浓度的盐酸分别中和等体积pH=12的氨水和NaOH溶液时,由于n(NH3·H2O)>n(NaOH);消耗盐酸的体积分别为V1、V2,则V1>V2。②用等浓度的盐酸分别中和等体积浓度均为0.01mol/L的氨水和NaOH溶液,因为二者的物质的量相等,所以消耗盐酸的体积也相等,因此V3=V4;③用等浓度的盐酸分别和等体积浓度均为0.01mol/L的氨水和NaOH溶液反应,若都恰好中和,则前者产生的是强酸弱碱盐,水解使溶液显酸性,所以若最后溶液均为中性,消耗盐酸的体积要略小写,因此V5<V6。
; ③A.增大容器的容积,NO2浓度减小,错误;B.再充入一定量的N2O4,即增大反应物的浓度,平衡正向移动,NO2浓度增大,正确;C.再充入一定量的NO2,平衡逆向移动,但是平衡移动消耗量远小于加入量,所以NO2浓度增大,正确;D.再充入一定量的He,对平衡无影响,NO2浓度不变,错误。(3)因为一水合氨是弱碱,NaOH是强碱,所以常温下①用等浓度的盐酸分别中和等体积pH=12的氨水和NaOH溶液时,由于n(NH3·H2O)>n(NaOH);消耗盐酸的体积分别为V1、V2,则V1>V2。②用等浓度的盐酸分别中和等体积浓度均为0.01mol/L的氨水和NaOH溶液,因为二者的物质的量相等,所以消耗盐酸的体积也相等,因此V3=V4;③用等浓度的盐酸分别和等体积浓度均为0.01mol/L的氨水和NaOH溶液反应,若都恰好中和,则前者产生的是强酸弱碱盐,水解使溶液显酸性,所以若最后溶液均为中性,消耗盐酸的体积要略小写,因此V5<V6。
考点:考查热化学方程式的书写、化学平衡常数、化学反应速率的计算、酸碱中和反应时体积关系的计算。

关于化学能与热能的叙述,正确的是( )
| A.1mol酸与碱恰好中和时所放出的热量叫中和热 |
| B.化学反应中的能量变化,主要是由化学键的变化引起的 |
| C.燃料电池反应时,化学能降低 |
| D.反应物的总能量高于生成物总能量的反应,不需要加热就可自行反应 |
下列说法或表示方法正确的是 ( )
| A.等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 |
| B.由H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ·mol-1可知,若将含1 mol CH3COOH的稀溶液与含1 mol NaOH的稀溶液混合,放出的热量小于57.3 kJ |
C.300℃、30MPa下,将0.5molN2(g)和1.5mol H2(g)置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g) 2NH3(g) △H=-38.6kJ·mol-1 2NH3(g) △H=-38.6kJ·mol-1 |
| D.由C(石墨)=C(金刚石)△H=" +1.90" kJ·mol-1可知,金刚石比石墨稳定 |
(7分)某同学模拟工业“折点加氯法”处理氨氮废水的原理,进行如下研究。
| 装置(气密性良好,试剂已添加) | 操作 | 现象 |
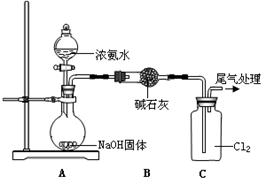 | 打开分液漏斗活塞,逐滴加入浓氨水 | ⅰ.C中气体颜色变浅 ⅱ.稍后,C中出现白烟并逐渐增多 |
(1)浓氨水分解可以制氨气,写出A中反应的化学方程式是 。从平衡移动 的角度分析NaOH固体在氨水分解中的作用 。
(2)现象ⅰ,C中发生的反应为:2NH3(g)+3Cl2(g)= N2(g)+6HCl(g) ?H=—456 kJ·mol-1
已知:
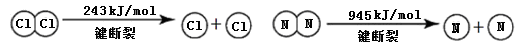
①NH3的电子式是 。
②断开1mol H-N键与断开1molH-Cl键所需能量相差约为 ,
(3)现象ⅱ中产生白烟的化学方程式是 。
(4)为避免生成白烟,该学生设计了下图装置以完成Cl2和NH3的反应。
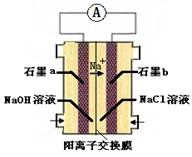
若该装置能实现设计目标,则①石墨b电极上发生的是 反应(填“氧化”或“还原”)
②写出石墨a电极的电极反应式: 。
(15分)甲醇是一种可再生能源,具有广泛的开发和应用前景.请回答下列与甲醇有关的问题.
(1)甲醇分子是____________分子(填“极性”或“非极性”).
(2)工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g) 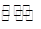 CH3OH(g)△H=﹣86.6KJ/mol,在T℃时,往一个体积固定为1L的密闭容器中加入1mol CO和2mol H2,反应达到平衡时,容器内的压强是开始时的3/5.
CH3OH(g)△H=﹣86.6KJ/mol,在T℃时,往一个体积固定为1L的密闭容器中加入1mol CO和2mol H2,反应达到平衡时,容器内的压强是开始时的3/5.
①达到平衡时,CO的转化率为____________
②下列选项能判断该反应达到平衡状态的依据的有____________
| A.2v(H2)=v(CH3OH) | B.CO的消耗速率等于CH3OH的生成速率 |
| C.容器内的压强保持不变 | D.混合气体的密度保持不变 |
(3)已知在常温常压下:
①2CH3OH(1)+3O2(g)=2CO2(g)+4H2O(g) △H=﹣akJ·mol﹣1
②2CO(g)+O2(g)=2CO2(g) △H=﹣bkl·mol﹣1
③H2O(g)=H2O(1) △H=﹣ckJ·mol﹣1
则CH3OH(1)+O2(g)==CO(g)+2H2O(1) △H=____________kJ·mol﹣1
(4)由甲醇、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电.
①该电池负极的电极反应式为____________________________________.
②若以该电池为电源,用石墨做电极电解200mL含有如下离子的溶液.
| 离子 | Cu2+ | H+ | Cl﹣ | SO42﹣ |
| c/mol·L﹣1 | 0.5 | 2 | 2 | 0.5 |
 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g) 

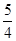 O2(g)=
O2(g)= P4O10(s);Δ H=-738.5KJ·mol-1
P4O10(s);Δ H=-738.5KJ·mol-1 说明这个反应是 (填“吸热”或“放热”)反应,NO2和CO的 总能量 (填“大于”、“小于”或“等于”)CO2和NO的总能量。
说明这个反应是 (填“吸热”或“放热”)反应,NO2和CO的 总能量 (填“大于”、“小于”或“等于”)CO2和NO的总能量。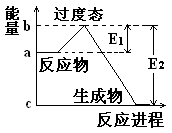
 CO2+NO,2 min时,测得容器中NO的物质的量为0.5 mol ,则:①此段时间内,用CO2表示的平均反应速率为 ②2 min时,容器内气体的总物质的量为_________.
CO2+NO,2 min时,测得容器中NO的物质的量为0.5 mol ,则:①此段时间内,用CO2表示的平均反应速率为 ②2 min时,容器内气体的总物质的量为_________. 
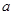 1等于 ;若反应温度由T1升高到T2,平衡时PCl5的分解率为
1等于 ;若反应温度由T1升高到T2,平衡时PCl5的分解率为