题目内容
【题目】我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该反应历程示意如下:

下列说法不正确的是
A.该反应遵循质量守恒定律
B.CH4→CH3COOH过程中,有C—H键发生断裂
C.①→②吸收能量并形成了C—C键
D.生成CH3COOH总反应的原子利用率为100%
【答案】C
【解析】
根据图示可知,CO2和CH4在催化剂存在下反应生成CH3COOH,总反应方程式为CO2+CH4→CH3COOH。
A项、CO2和CH4在催化剂存在下反应生成CH3COOH遵循质量守恒定律,故A正确;
B项、CH4选择性活化变为CH3COOH过程中,有1个C-H键发生断裂,故B正确;
C项、根据图示,①的总能量高于②的总能量,①→②放出能量,对比①和②,①→②形成了C-C键,故C错误;
D项、该反应只有CH3COOH一种生成物,原子利用率为100%,故D正确;
故选C。

 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案【题目】如图装置可用于验证气体的某些化学性质,所得现象和结论均正确的是
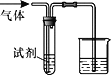
气体 | 试剂 | 现象 | 结论 | |
A | CH2=CH2 | 溴水 | 溶液褪色 | C2H4能与Br2发生取代反应 |
B | CO2 | BaCl2溶液 | 产生白色沉淀 | CO2能与可溶性钡盐反应 |
C | Cl2 | FeCl2溶液 | 溶液变为棕黄色 | 氧化性Cl2>Fe3+ |
D | SO2 | KMnO4溶液 | 溶液褪色 | SO2有漂白性 |
A. A B. B C. C D. D
【题目】硫酸镁晶体(MgSO4·7H2O)是一种重要的化工原料。以菱镁矿(主要成分是MgCO3,含少量FeCO3和不溶性杂质)为原料制取硫酸镁晶体的过程如下:
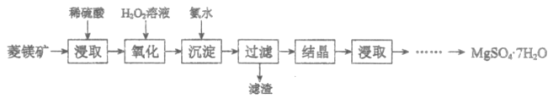
(1)MgCO3溶于稀硫酸的离子方程式是___________。
(2)“氧化”步骤中,加入H2O2溶液的目的是___________(用离子方程式表示)。
(3)“沉淀”步骤中,用氨水调节溶液pH的范围是___________。
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
阳离子 | Mg2+ | Fe2+ | Fe3+ |
开始沉淀 | 9.1 | 7.6 | 1.9 |
完全沉淀 | 11.1 | 9.7 | 3.2 |
(4)“过滤”所得滤液中含有的阳离子是___________。



