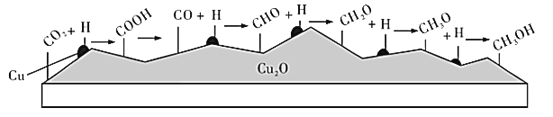
题目内容
【题目】某温度下,在2L容器中3种物质间进行反应,X,Y,Z的物质的量随时间的变化曲线如图,反应在t1 min时到达平衡,如图所示:
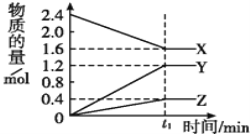
(1)该反应的化学方程式是_________。若t1=10min,用X表示化学反应速率为_________
(2)若上述反应中X,Y,Z分别为NH3、H2、N2, 且已知1mol氨气分解成氮气和氢气要吸收46kJ的热量,则至t1 min时,该反应吸收的热量为_______;
(3)保持容器温度不变,缩小容器体积,化学反应速率_______(填“增大”或“减小”或“不变”)。化学平衡常数K_______ (填“增大”或“减小”或“不变”)
(4)在一定容积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
t/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
①该反应的化学平衡常数表达式为K=__________
②能判断该反应达到化学平衡状态的依据是_______
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO2)=c(CO)
(5)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为__________℃;
(6)在800℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)=2mol·L-1,c(H2)=1.5mol·L-1,c(CO)=1mol·L-1,c(H2O)=3mol·L-1,则下一时刻,反应向__________(填"正反应"或"逆反应")方向进行。
【答案】2X![]() 3Y+Z 0.04mol/(Lmin) 36.8kJ 增大 不变
3Y+Z 0.04mol/(Lmin) 36.8kJ 增大 不变 ![]() BC 830 逆反应
BC 830 逆反应
【解析】
(1)化学反应中,各物质的物质的量的变化值与化学计量数成正比,且反应进行到t1时各种物质都存在,物质的量都不发生变化,说明反应为可逆反应,以此书写化学方程式;根据v=![]() 计算反应速率;
计算反应速率;
(2)若上述反应中X、Y、Z分别为NH3、H2、N2,且已知1mol 氨气分解成氮气和氢气要吸收46kJ的热量,则至t1min时,分解氨气物质的量△n(NH3)=2.4mol-1.6mol=0.8mol,据此计算反应放出的热量;
(3)根据压强对化学反应速率和化学平衡移动的影响分析判断;
(4)①根据化学平衡常数的概念来书写;②化学平衡状态的标志:正逆反应速率相等;
(5)根据c(CO2)·c(H2)=c(CO)·c(H2O)进行整理,并与化学平衡常数K比较判断反应温度;
(6)将该时刻的浓度代入浓度商公式,并与800℃时的化学平衡常数K比较判断反应进行的方向。
(1)由图象可以看出,X的物质的量逐渐减小,则X为反应物,Y、Z的物质的量逐渐增多,则Y、Z为生成物,当反应到达2min时,△n(X)=0.8mol,△n(Y)=1.2mol,△n(Z)=0.4mol,化学反应中,各物质的物质的量的变化值与化学计量数成正比,则△n(X):△n(Y):△n(Z)=2:3:1,此时各种物质的浓度都不再发生变化,说明反应达到了平衡状态,所以反应的化学方程式为:2X![]() 3Y+Z;
3Y+Z;
反应从开始至达到平衡,X的物质的量变化了0.8mol,则用X表示的反应速率v(X)= =0.04mol/(Lmin);
=0.04mol/(Lmin);
(2)若上述反应中X、Y、Z分别为NH3、H2、N2,且已知1mol 氨气分解成氮气和氢气要吸收46kJ的热量,则至t1 min时,分解氨气物质的量△n(NH3)=2.4mol-1.6mol=0.8mol,反应放出的热量Q=![]() =36.8 kJ;
=36.8 kJ;
(3)该反应有气体参加,保持容器温度不变,缩小容器体积,物质的浓度增大,所以化学反应速率增大,由于化学平衡常数K只与温度有关,温度不变,所以化学平衡常数K不变;
(4)①因平衡常数等于生成物的浓度幂之积与反应物的浓度幂之积的比,所以化学平衡常数K=![]() ;
;
②A.反应是一个反应前后体积不变的反应,压强的改变不会要引起平衡移动,A错误;
B.化学平衡时,各组分的浓度不随时间的改变而改变,B正确;
C.化学平衡状态的标志是v正=v逆,所以v正(H2)=v逆(H2O)表明反应达到平衡状态,C正确;
D.c(CO2)=c(CO)时,不能表明正逆反应速率相等,不一定达到了平衡状态,D错误;
故合理选项是BC;
(5) c(CO2)·c(H2)=c(CO)·c(H2O),则![]() =1,与830℃时达到化学平衡常数K相等,因此反应温度为830℃;
=1,与830℃时达到化学平衡常数K相等,因此反应温度为830℃;
(6)在800℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)=2mol/L,c(H2)=1.5mol/L,c(CO)=1mol/L,c(H2O)=3mol/L,则Qc=![]() =1,大于800℃时的化学平衡K=0.9,说明化学反应逆反应方向进行。
=1,大于800℃时的化学平衡K=0.9,说明化学反应逆反应方向进行。

【题目】海洋资源的开发与利用具有广阔的前景。海水的pH一般在7.5~8.6之间。某地海水中主要离子的含量如下表:
成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO42- | HCO3- |
含量/mgL-1 | 9360 | 83 | 160 | 1100 | 16000 | 1200 | 118 |
(1)海水显弱碱性的原因是(用离子方程式表示):____________,该海水中Ca2+的物质的量浓度为__________mol/L 。
(2)电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如下图所示。其中阴(阳)离子交换膜只允许阴(阳)离子通过,电极均为惰性电极。

① 开始时阳极的电极反应式为________________。
② 电解一段时间,____极(填“阴”或“阳”)会产生水垢,其成份为_____(填化学式)。
③ 淡水的出口为a、b、c中的__________出口。
(3)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力。锂是制造化学电源的重要原料,如LiFePO4电池某电极的工作原理如图所示:

该电池电解质为能传导 Li+的固体材料。
上面左图中的小黑点表示_____(填粒子符号),充电时该电极反应式为_______。
(4)利用海洋资源可获得MnO2 。MnO2可用来制备高锰酸钾:将MnO2与KOH混合后在空气中加热熔融,得到绿色的锰酸钾(K2MnO4),再利用氯气将锰酸钾氧化成高锰酸钾。该制备过程中消耗相同条件下氯气和空气的体积比为_________(空气中氧气的体积分数按20%计)。
【题目】已知:[FeCl4(H2O)2]-呈黄色,由下列实验所得结论不正确的是( )
① | ② | ③ | ④ |
0.1mol/L Fe2(SO4)3溶液 |
酸化的0.1mol/L Fe2(SO4)3溶液 |
酸化的0.1mol/L Fe2(SO4)3溶液 |
0.1mol/L FeCl3溶液 |
加热前溶液为浅黄色,加热后颜色变深 | 加热前溶液接近无色,加热后溶液颜色无明显变化 | 加入NaCl后,溶液立即变为黄色,加热后溶液颜色加深 | 加热前溶液为黄色,加热后溶液颜色变深 |
注:加热为微热,忽略溶液体积变化。
A.实验①中,Fe2(SO4)3溶液显浅黄色的原因是Fe3+水解产生了少量Fe(OH)3
B.实验②中,酸化对Fe3+水解的影响程度大于温度的影响
C.实验③中,存在平衡:Fe3+ +4Cl- +2H2O![]() [FeCl4(H2O)2]-
[FeCl4(H2O)2]-
D.实验④中,可证明升高温度,Fe3+水解平衡一定正向发生移动
【题目】某化学小组为了研究外界条件对化学反应速率的影响,进行了酸性高锰酸钾与草酸(H2C2O4)的反应,记录如表所示的实验数据:
实验 | 实验 | 试管中所加试剂及其用量/mL | 溶液褪至无 | |||
编号 | 温度 | 0.6mol/L H2C2O4 溶液 | H2O | 3mol/L H2SO4 稀溶液 | 0.05mol/L KMnO4 溶液 | 色所需时间 /min |
① | 25 | 3.0 | V1 | 2.0 | 3.0 | 1.5 |
② | 25 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
③ | 50 | 2.0 | V2 | 2.0 | 3.0 | 1.0 |
(1)请写出该反应的离子方程式 ______,当该反应以表中数据反应完全时转移电子数为NA。
(2)V1=_______mL。
(3)根据表中的实验①、②数据,可以得到的结论是 _______。
(4)探究温度对化学反应速率的影响,应选择 _______(填实验编号)
实验编号 | 实温度 /℃ | 试管中所加试剂及其用量 | 再加入某种固体 | 溶液褪至无色所需时间/min | |||
④ | 25 | 0.6mol/L H2C2O4 | H2O | 3mol/L H2SO4 | 0.05mol/L KMnO4溶液 | ||
2.0 | 3.0 | 2.0 | 3.0 | MnSO4 | t | ||
(5)该小组根据经验绘制了 n (Mn 2+)随时间变化的趋势如图 1 所示,但有同学查阅已有实验资料发现,该实验过程中 n (Mn 2+)随时间变化的实际趋势如图 2 所示。
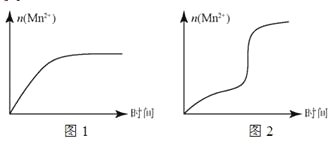
该小组同学根据图 2 所示信息提出了新的假设,并设计实验方案④继续进行实验探究。
②小组同学提出的假设是________。
②若该小组同学提出的假设成立,应观察到________现象。