��Ŀ����
����Ŀ��A��B��C���������о�����ͬһ��Ԫ�أ�����֮�������ͼ��ʾ��ת����ϵ�����ַ�Ӧ������ȥ���� 
��ش��������⣺
��1����A��һ�ֽ��������B��C��Ϊ������B��ˮ��Һ�����ԣ�C��ˮ��Һ�ʼ��ԣ���д����Ӧ�ٺͷ�Ӧ�ܣ�A��һ��ת��ΪB��C�������ӷ���ʽ����Ӧ�� �� ��Ӧ��
��2������Ӧ��Ϊ�û���Ӧ����Ӧ��Ϊ���Ϸ�Ӧ��C���ʴ��������ں�ˮ�У����������������ȱ�ٵ����ʣ���ҵ�Ͽ�����C����ȡA��B����д����������Ӧ�Ļ�ѧ����ʽ��C��A��C��B ��
��3������Ӧ�٢ڢ۾�Ϊ���Ϸ�Ӧ����Ӧ��Ϊ�û���Ӧ����AΪһ�ֽ�������ʱ����д����Ӧ�ں͢ۿ��ܵ����ӷ���ʽ����Ӧ�ڣ�����Ӧ�ۣ� ��
���𰸡�
��1��Al2O3+6H+=2Al3++3H2O��Al2O3+2OH��=2AlO2��+H2O
��2��2NaCl�����ڣ� ![]() 2Na+Cl2����2NaCl+2H2O
2Na+Cl2����2NaCl+2H2O ![]() 2NaOH+H2��+Cl2��
2NaOH+H2��+Cl2��
��3��2Fe3++Fe=3Fe2+��2Fe2++Cl2=2Fe3++2Cl������2Fe2++Br2=2Fe3++2Br����
���������⣺��1�������������Ӧ������B��C��ˮ��Һ�ֱ�����ԡ����ԣ����л�ѧֻ������������ž��������������������뵽����������Al2O3 �� ��B����Al3+ �� C����AlO2�� �� ��Ӧ��ΪAl2O3+6H+=2Al3++3H2O����Ӧ��ΪAl2O3+2OH��=2AlO2��+H2O��
���Դ��ǣ�Al2O3+6H+=2Al3++3H2O�� Al2O3+2OH��=2AlO2��+H2O����2��C���ʴ��������ں�ˮ�У����������������ȱ�ٵ����ʣ�ӦΪNaCl����ҵ�Ͽ�����C����ȡA��B����AΪNa��BΪNaOH��
C��A�����õ�����ڵ�NaCl��Ӧ�Ʊ�������ʽΪ2NaCl�����ڣ� ![]() 2Na+Cl2����C��B�����õ�ⱥ��ʳ��ˮ�Ʊ�����ӦΪ2NaCl+2H2O
2Na+Cl2����C��B�����õ�ⱥ��ʳ��ˮ�Ʊ�����ӦΪ2NaCl+2H2O ![]() 2NaOH+H2��+Cl2����
2NaOH+H2��+Cl2����
���Դ��ǣ�2NaCl�����ڣ� ![]() 2Na+Cl2���� 2NaCl+2H2O
2Na+Cl2���� 2NaCl+2H2O ![]() 2NaOH+H2��+Cl2������3���������������������Ϸ�Ӧ���������뵽�����������²�AΪ��۽�����������������Ӧ�õ��Ȼ������Ȼ���������Ӧ�õ��Ȼ��������Ȼ�������������Ӧ�õ��Ȼ������������ᷢ���û���Ӧ���Եõ��Ȼ�������Ҳ������������ķ�Ӧ����Ӧ��Ϊ2Fe3++Fe=3Fe2+ �� ��Ӧ��Ϊ2Fe2++Cl2=2Fe3++2Cl������2Fe2++Br2=2Fe3++2Br������
2NaOH+H2��+Cl2������3���������������������Ϸ�Ӧ���������뵽�����������²�AΪ��۽�����������������Ӧ�õ��Ȼ������Ȼ���������Ӧ�õ��Ȼ��������Ȼ�������������Ӧ�õ��Ȼ������������ᷢ���û���Ӧ���Եõ��Ȼ�������Ҳ������������ķ�Ӧ����Ӧ��Ϊ2Fe3++Fe=3Fe2+ �� ��Ӧ��Ϊ2Fe2++Cl2=2Fe3++2Cl������2Fe2++Br2=2Fe3++2Br������
���Դ��ǣ�2Fe3++Fe=3Fe2+��2Fe2++Cl2=2Fe3++2Cl������2Fe2++Br2=2Fe3++2Br������

����Ŀ����֪������ݣ�
��ѧʽ | ����ƽ�ⳣ����25�棩 |
HCN | K=5.0��10��10 |
H2CO3 | K1=4.4��10��7 �� K2=4.7��10��11 |
��NaCN��Һ��ͨ������CO2 �� ��������Ӧ�Ļ�ѧ����ʽΪ ��
����Ŀ����������Ϊһ�����ʹ��ܵ�أ���Ӧ���õ����Ӻͷ�չ��
��1��Al��NO3��3���Ʊ������ز�����ԭ��֮һ������Al��NO3��3�������ջ����е�ˮ�֣������Ҫ������ж������������岽����ͼ��ʾ�� 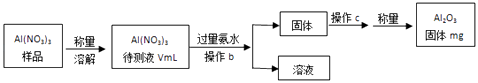
�ټ��������ˮ������Ӧ�����ӷ���ʽΪ�� ��
�ڲ���bΪ��
��Al��NO3��3����Һ�У�c��Al3+��=mol/L���ú�m��V�Ĵ���ʽ��ʾ����
��2�������������ڽ����ơ�������Ͷ����ƣ�Na2SX���ֱ���Ϊ�����缫�ķ�Ӧ�����Al2O3�մɣ��ɴ���Na+��Ϊ����ʣ��䷴Ӧԭ����ͼ1��ʾ�� 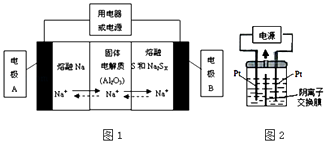
���� | Na | S | Al2O3 |
�۵�/�� | 97.8 | 115 | 2050�� |
�е�/�� | 892 | 444.6 | 2980 |
�ٸ��ݱ����ݣ������жϸõ�ع���������Ӧ������������ĸ����Χ�ڣ�
A.100������ B.100��300��C.300��350��D.350��2050��
�ڷŵ�ʱ���缫AΪ�����缫B������Ӧ���������ԭ����
�۳��ʱ���ܷ�ӦΪNa2SX�T2Na+xS��3��x��5�����������ĵ缫��ӦʽΪ�� ��
��3��������������Ϊ��Դ��������װ��KI��������Һ��ͼ2��ʾ�����ڵ��м��������ӽ���Ĥ������ͨ��һ��ʱ����������Һ����ɫ��һ��ʱ�����ɫ��dz�����Ҳ���ĵ缫����ʽ�����Է��������Һ��ɫ��dz�Ŀ���ԭ���ǣ� ��

