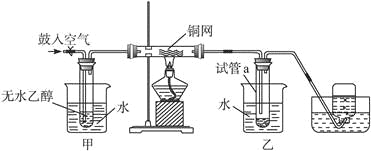
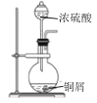
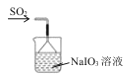
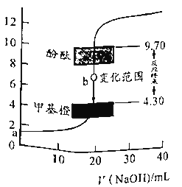
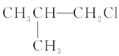题目内容
【题目】高铁酸钠(Na2FeO4)具有优良的杀菌效果,是一种理想的含氯杀菌剂替代品。以低碳钢板作为阳极电解浓氢氧化钠可以迅速制得高铁酸钠,其工作原理如图所示。下列说法正确的是
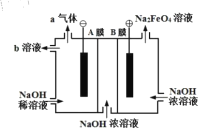
A.“A膜”、“B膜”分别为阴、阳离子交换膜
B.阴极区溶液的pH将减小
C.a气体为H2,,b溶液可循环使用
D.阳极反应为:![]()
【答案】C
【解析】
以低碳钢板作为阳极电解浓氢氧化钠制得高铁酸钠,阳极反应为![]() ,阳极消耗OH-,所以B膜为阴离子交换膜,允许OH-通过,阴极反应为:
,阳极消耗OH-,所以B膜为阴离子交换膜,允许OH-通过,阴极反应为:![]() ,阴极产生OH-,所以A膜为阳离子交换膜,允许钠离子通过。
,阴极产生OH-,所以A膜为阳离子交换膜,允许钠离子通过。
A. 根据题意,阳极反应为![]() ,阳极消耗OH-,所以B膜为阴离子交换膜,允许OH-通过,阴极反应为:
,阳极消耗OH-,所以B膜为阴离子交换膜,允许OH-通过,阴极反应为:![]() ,阴极产生OH-,所以A膜为阳离子交换膜,允许钠离子通过。即 “A膜”、“B膜”分别为阳、阴离子交换膜,A项错误;
,阴极产生OH-,所以A膜为阳离子交换膜,允许钠离子通过。即 “A膜”、“B膜”分别为阳、阴离子交换膜,A项错误;
B. 阴极反应为:![]() ,产生OH-,故溶液的pH将变大,B项错误;
,产生OH-,故溶液的pH将变大,B项错误;
C. 阴极反应为:![]() ,所以a气体为H2,,b溶液为浓的氢氧化钠可循环使用,C项正确;
,所以a气体为H2,,b溶液为浓的氢氧化钠可循环使用,C项正确;
D. 阳极反应为:![]() ,D项错误。
,D项错误。
答案选C。

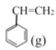
【题目】苯乙烯是一种重要的化工原料。工业中以乙苯![]() 为原料,采用催化脱氢的方法制取苯乙烯
为原料,采用催化脱氢的方法制取苯乙烯![]() 。回答下列问题:
。回答下列问题:
己知:①![]()
![]()
 +H2(g) △H1>0
+H2(g) △H1>0
②![]() △H2>0
△H2>0
(1)![]() +CO2(g)
+CO2(g)![]()
![]() +CO(g)+H2O(g) △H=_______,(用△H 1、△H 2表示)有利于提高己苯平衡转化率的条件是____(填标号)。
+CO(g)+H2O(g) △H=_______,(用△H 1、△H 2表示)有利于提高己苯平衡转化率的条件是____(填标号)。
a 高温 b 高压 c 低温 d 低压
(2)已知T1℃下,将1mol乙苯蒸气通入到体积为2L的密闭容器中进行反应①,容器内气体总物质的量随反应时间的变化情况如下表所示:
时间t/min | 0 | 10 | 20 | 30 | 40 |
总物质的量n/mol | 1.0 | 1.4 | 1.65 | 1.8 | 1.8 |
①由表中数据计算0~10min内v(H2)=____:平衡时乙苯的转化率为____
②T1℃下该反应的平衡常数K1=____
③若温度T1℃下的平衡常数K小于T2℃下的平衡常数K2,则T1____T2(填“>”、 “<”或“=”)