题目内容
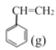
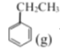
【题目】苯乙烯是一种重要的化工原料。工业中以乙苯![]() 为原料,采用催化脱氢的方法制取苯乙烯
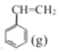
为原料,采用催化脱氢的方法制取苯乙烯![]() 。回答下列问题:
。回答下列问题:
己知:①![]()
![]()
 +H2(g) △H1>0
+H2(g) △H1>0
②![]() △H2>0
△H2>0
(1)![]() +CO2(g)
+CO2(g)![]()
![]() +CO(g)+H2O(g) △H=_______,(用△H 1、△H 2表示)有利于提高己苯平衡转化率的条件是____(填标号)。
+CO(g)+H2O(g) △H=_______,(用△H 1、△H 2表示)有利于提高己苯平衡转化率的条件是____(填标号)。
a 高温 b 高压 c 低温 d 低压
(2)已知T1℃下,将1mol乙苯蒸气通入到体积为2L的密闭容器中进行反应①,容器内气体总物质的量随反应时间的变化情况如下表所示:
时间t/min | 0 | 10 | 20 | 30 | 40 |
总物质的量n/mol | 1.0 | 1.4 | 1.65 | 1.8 | 1.8 |
①由表中数据计算0~10min内v(H2)=____:平衡时乙苯的转化率为____
②T1℃下该反应的平衡常数K1=____
③若温度T1℃下的平衡常数K小于T2℃下的平衡常数K2,则T1____T2(填“>”、 “<”或“=”)
【答案】△H1+△H2 ad 0.02molL-1min-1 80% 1.6 <
【解析】
根据盖斯定理,结合升高温度平衡向着吸热的方向移动,增大压强,平衡向着体积减小的方向移动来解答。
(1)根据盖斯定理,①+②可得:
 +CO2(g)
+CO2(g)![]()
 +CO(g)+H2O(g) △H=△H1+△H2,由△H1+△H2>0可知该反应为吸热反应,升高温度平衡向着吸热的方向移动,故选a。该反应是一个气体体积增大的反应,减小压强,平衡向着气体体积增大的方向移动,故选d。综上所述,ad符合要求。
+CO(g)+H2O(g) △H=△H1+△H2,由△H1+△H2>0可知该反应为吸热反应,升高温度平衡向着吸热的方向移动,故选a。该反应是一个气体体积增大的反应,减小压强,平衡向着气体体积增大的方向移动,故选d。综上所述,ad符合要求。
(2)①根据表中数据和反应①的特点可知,在0~10min内气体总物质的量增加了0.4mol,说明在这段时间内氢气的变化量也是0.4mol,则 ![]() ;平衡时气体总物质的量增加了0.8mol,所以平衡时乙苯的转化率为80%;
;平衡时气体总物质的量增加了0.8mol,所以平衡时乙苯的转化率为80%;
②T1℃下该反应的平衡常数K1= =1.6;
=1.6;
③若温度T1℃下的平衡常数K小于T2℃下的平衡常数K2,由于反应吸热,温度升高,平衡正向移动,K值变大,则T1<T2。