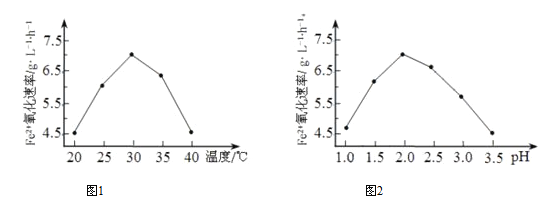
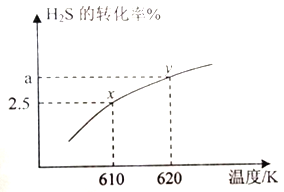
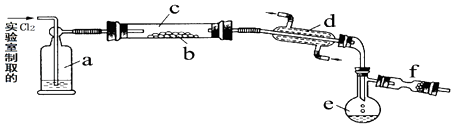
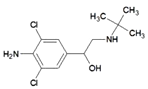
题目内容
【题目】阅读表短周期主族元素的相关信息:
元素代号 | 相关信息 |
A | A的单质能与冷水剧烈反应,得到强碱性溶液 |
B | B的原子最外层电子数是其内层电子数的三倍 |
C | 在第3周期元素中,C的简单离子半径简单最小 |
D | A、B、D组成的36电子的化合物X是家用消毒剂的主要成分 |
E | 所有有机物中都含有E元素 |
请回答:
(1)写出E在元素周期表中的位置:;C的简单离子的结构示意图: .
(2)X的化学式为 .
(3)A,B,C三种元素的简单离子的半径由大到小的顺序为(用离子符号表示).
(4)A,B两元素组成的化合物A2B2属于(填“离子”或“共价”化合物).
(5)C元素形成的单质能与A的最高价氧化物对应的水化物反应,其离子方程式为 .
【答案】
(1)第二周期第ⅣA族;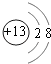
(2)NaClO
(3)O2﹣>Na+>Al3+
(4)离子化合物
(5)2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑
【解析】解:(1)E为碳元素,原子有2个电子层,最外层电子数为4,原子结构示意图为 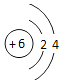 ,处于周期表中第二周期第ⅣA族;C为铝元素,铝离子核外电子数为10,有2个电子层,最外层电子数为8,离子结构示意图为
,处于周期表中第二周期第ⅣA族;C为铝元素,铝离子核外电子数为10,有2个电子层,最外层电子数为8,离子结构示意图为 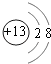 , 所以答案是:第二周期第ⅣA族;
, 所以答案是:第二周期第ⅣA族; 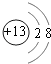 ;(2)短周期主族元素,A的单质能与冷水剧烈反应,得到强碱性溶液,则A为钠元素;B的原子最外层电子数是其内层电子数的三倍,B有2个电子层,最外层电子数为6,故B为氧元素;A,B,D组成的36电子的化合物X是家用消毒剂的主要成分,X为NaClO,所以答案是:NaClO;(3)A、B、C三种元素形成的简单离子分别为Na+、O2﹣、Al3+ , 离子的电子层排布相同,核电荷数越大,离子半径越小,所以离子半径由大到小的顺序为O2﹣>Na+>Al3+ , 所以答案是:O2﹣>Na+>Al3+;(4)A、B形成的一种A2B2化合物的化学式为Na2O2 , 由钠离子和过氧根离子构成,存在的化学键有离子键、共价键,属于离子化合物,所以答案是:离子化合物;(5)C为铝元素,A为钠元素,C元素形成的单质能与A的最高价氧化物水合物反应,其离子方程式为:2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑,所以答案是:2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑.
;(2)短周期主族元素,A的单质能与冷水剧烈反应,得到强碱性溶液,则A为钠元素;B的原子最外层电子数是其内层电子数的三倍,B有2个电子层,最外层电子数为6,故B为氧元素;A,B,D组成的36电子的化合物X是家用消毒剂的主要成分,X为NaClO,所以答案是:NaClO;(3)A、B、C三种元素形成的简单离子分别为Na+、O2﹣、Al3+ , 离子的电子层排布相同,核电荷数越大,离子半径越小,所以离子半径由大到小的顺序为O2﹣>Na+>Al3+ , 所以答案是:O2﹣>Na+>Al3+;(4)A、B形成的一种A2B2化合物的化学式为Na2O2 , 由钠离子和过氧根离子构成,存在的化学键有离子键、共价键,属于离子化合物,所以答案是:离子化合物;(5)C为铝元素,A为钠元素,C元素形成的单质能与A的最高价氧化物水合物反应,其离子方程式为:2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑,所以答案是:2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑.