题目内容
下列各选项所描述的两个量中,前者一定大于后者的是
| A.pH=3的盐酸的Cl-浓度和pH=3的醋酸溶液的CH3COO-浓度 |
| B.pH相同的氨水和醋酸钠溶液中,由水电离产生的c(H+) |
| C.中和100mLPH=1的醋酸和100mLPH=1的盐酸所消耗的NaOH的物质的量 |
| D.pH=11的NaOH和pH=11的氨水分别稀释100倍后的pH |
C
pH=3的盐酸的Cl-浓度是0.001mol/L,醋酸是弱电解质,电离出的氢离子和CH3COO-浓度是相同的,所以pH=3的醋酸溶液的CH3COO-浓度也是0.001mol/L,A不正确。氨水是碱,抑制水的电离的,醋酸钠水解,促进是的电离,B不正确。醋酸是弱酸,所以pH相同的醋酸和盐酸,前者的浓度要大于后者,因此前者消耗的氢氧化钠多,C正确。稀释促进氨水的电离,所以稀释后氨水中OH-的物质的量要大于氢氧化钠中的OH-的物质的量,即氢氧化钠的碱性要弱于后者,因此前者的小于后者,D不正确。答案选C。

练习册系列答案
相关题目
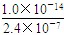 mol/L
mol/L
 的绝对值均正确)
的绝对值均正确)