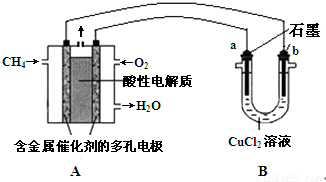
题目内容
17.某有机物1.6g在足量的氧气中燃烧后测得生成二氧化碳的质量为4.4g,水的质量为3.6g则( )| A. | 有机物一定含C,H元素,可能含氧元素 | |
| B. | 有机物只含C,H元素 | |
| C. | 有机物含C,H,O元素 | |
| D. | 此有机物化学式为CH4 |
分析 n(CO2)=$\frac{4.4g}{44g/mol}$=0.1mol,n(H2O)=$\frac{3.6g}{18g/mol}$=0.2mol,则m(C)=0.1mol×12g/mol=1.2g,m(H)=0.2mol×2×1g/mol=0.4g,结合质量守恒判断是否含有氧元素.
解答 解:n(CO2)=$\frac{4.4g}{44g/mol}$=0.1mol,n(H2O)=$\frac{3.6g}{18g/mol}$=0.2mol,则m(C)=0.1mol×12g/mol=1.2g,m(H)=0.2mol×2×1g/mol=0.4g,1.2g+0.4g=1.6g,则说明1.6g有机物只含有C、H两种元素,且C、H物质的量之比为0.1mol:0.2mol×2=1:4,为CH4,
故选BD.
点评 本题考查的分子式以及分子组成的确定,为高频考点,侧重于学生的分析能力和计算能力的考查,做题时注意把握题中关键信息,难度不大.

练习册系列答案
相关题目
5.某同学用量筒量取液体时,将量筒放平稳,倒入液体,面对刻度线,第一次仰视凹液面最低处,读数为29ml;到出部分液体后,又俯视凹液面最低处,读数为11ml,该同学倒出的液体体积是( )
| A. | 18ml | B. | 大于18ml | C. | 小于18ml | D. | 无法判断 |
12.已知元素M(只有一种化合价)的氧化物的化学式是M2O3,则它与硝酸根离子形成的化合物的化学式为( )
| A. | M(NO3)2 | B. | M(NO3)3 | C. | MNO3 | D. | M2(NO3)2 |
6.下列反应离子方程式书写正确的是( )
| A. | 钠和冷水反应:Na+2H2O═Na++OH-+H2↑ | |
| B. | 金属铝溶于氢氧化钠:Al+2OH-═AlO2-+H2↑ | |
| C. | 金属铝溶于盐酸中2Al+6H+═2Al3++3H2↑ | |
| D. | 铁跟稀盐酸反应:Fe+2H+═Fe3++H2↑ |
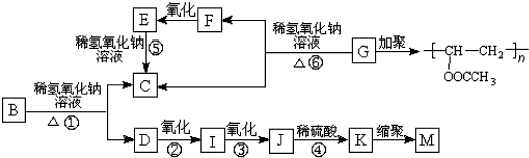
 .
.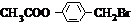 +3NaOH$→_{△}^{水}$CH3COONa+
+3NaOH$→_{△}^{水}$CH3COONa+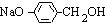 +NaBr+H2O,
+NaBr+H2O,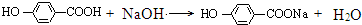 .
.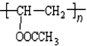 在氢氧化钠溶液中加热:
在氢氧化钠溶液中加热: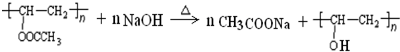 .
.