题目内容
【题目】纳米材料一直是人们研究的重要课题,例如纳米级Fe粉表面积大,具有超强的磁性、高效催化性等优良的性质。
Ⅰ.实验室采用气相还原法制备纳米级Fe,其流程如图所示:

(1)纳米级Fe和稀盐酸反应的离子方程式为__________________________。
(2)如何将FeCl2·nH2O固体加热脱水制得无水FeCl2_________(用简要文字描述)。
(3)生成纳米级Fe的化学方程式为__________________。
Ⅱ.查阅资料:在不同温度下,纳米级Fe粉与水蒸气反应的固体产物不同,温度低于570 ℃时生成FeO,高于570 ℃时生成Fe3O4。甲同学用如图甲所示装置进行纳米级Fe粉与水蒸气反应的实验,乙同学用图乙所示的装置进行纳米级Fe粉与水蒸气的反应并验证产物。
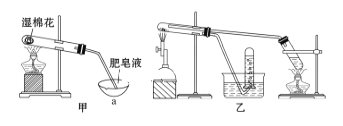
(4)甲装置中纳米级Fe粉与水蒸气反应的化学方程式是____________。
(5)乙同学为探究实验结束后试管内的固体物质成分,进行了下列实验:
实验步骤 | 实验操作 | 实验现象 |
① | 将反应后得到的黑色粉末X(假定为均匀的),取出少量放入另一试管中,加入少量盐酸,微热 | 黑色粉末逐渐溶解,溶液呈浅绿色;有少量气泡产生 |
② | 向实验①得到的溶液中滴加几滴KSCN溶液,振荡 | 溶液没有出现红色 |
根据以上实验,乙同学认为该条件下反应的固体产物为FeO。丙同学认为乙同学的结论不正确,他的理由是________(用简要文字描述)。
(6)丁同学称取5.60 g Fe粉,用乙装置反应一段时间后,停止加热。将试管内的固体物质在干燥器中冷却后,称得质量为6.88 g,则丁同学实验后的固体物质中氧化物的质量分数为___(结果保留三位有效数字)。
【答案】Fe+2H+=Fe2++H2↑ 在干燥的HCl气流中加热 FeCl2+H2![]() Fe+2HCl Fe+H2O(g)
Fe+2HCl Fe+H2O(g)![]() FeO+H2 加入KSCN溶液,溶液没有出现红色,也可能是因为Fe过量,与生成的Fe3+反应转化为Fe2+ 67.4%
FeO+H2 加入KSCN溶液,溶液没有出现红色,也可能是因为Fe过量,与生成的Fe3+反应转化为Fe2+ 67.4%
【解析】
Ⅰ. (1)纳米级Fe和稀盐酸反应生成FeCl2和H2,据此写出离子方程式;
(2) FeCl2·nH2O固体加热脱水时,易发生水解,为防止FeCl2水解,在加热脱水时,通常通入干燥的HCl气体,抑制水解;
(3)根据流程可知,FeCl2·nH2O固体加热脱水得到FeCl2,然后N2、H2与FeCl2在高温条件下反应得到纳米级Fe,据此写出反应方程式;
Ⅱ. (4)根据已知“纳米级Fe粉与水蒸气反应,温度低于570℃时生成FeO、氢气,据此写出反应方程式;
(5)用KSCN溶液检验 Fe3+;纳米级Fe粉与水蒸气反应的过程中Fe过量,Fe没有反应完;将反应后的固体加入少量的盐酸,也可能发生反应Fe+2Fe3+=3Fe2+ ,据此进行分析;
(6) 用乙装置反应,反应温度高于570℃,则Fe粉与水蒸气反应的固体产物为Fe3O4.反应后所得固体的质量为6.88g,其中氧原子的质量为m(O)=6.88g5.60g=1.28g,则n(O)=![]() =0.08mol;由关系式1Fe3O44O,可得n(Fe3O4)=0.02mol;据此计算出固体物质中氧化物的质量分数。
=0.08mol;由关系式1Fe3O44O,可得n(Fe3O4)=0.02mol;据此计算出固体物质中氧化物的质量分数。
Ⅰ. (1)纳米级Fe和稀盐酸反应生成FeCl2和H2,离子方程式为Fe+2H+=Fe2++H2↑,
答案为:Fe+2H+=Fe2++H2↑;
(2) FeCl2·nH2O固体加热脱水时,易发生水解,水解方程式为FeCl2 + 2H2OFe(OH)2+2HCl,为防止FeCl2水解,在加热脱水时,通常通入干燥的HCl气体,HCl能抑制FeCl2的水解,且通入的HCI气体可带走水蒸气,利于固体脱水,
故答案为:在干燥的HCl气流中加热;
(3)根据流程可知,FeCl2·nH2O固体加热脱水得到FeCl2,然后N2、H2与FeCl2在高温条件下反应得到纳米级Fe,反应方程式为FeCl2+H2![]() Fe+2HCl,
Fe+2HCl,
答案为:FeCl2+H2![]() Fe+2HCl;
Fe+2HCl;
Ⅱ. (4)根据已知“纳米级Fe粉与水蒸气反应,温度低于570℃时生成FeO,甲装置用酒精灯加热,反应温度较低,产物为FeO;Fe失电子,水中H得电子,生成氢气,则反应方程式为Fe+H2O(g)![]() FeO+H2,
FeO+H2,
答案为:Fe+H2O(g)![]() FeO+H2
FeO+H2
(5)加入KSCN溶液,溶液没有出现红色,说明溶液中没有Fe3+,可能是因为纳米级Fe粉与水蒸气反应的过程中Fe过量,Fe没有反应完;将反应后的固体加入少量的盐酸,也可能发生反应Fe+2Fe3+=3Fe2+ ,所以看不到血红色。
故答案为:加入KSCN溶液,溶液没有出现红色,也可能是因为Fe过量,与生成的Fe3+反应转化为Fe2+。
(6) 用乙装置反应,反应温度高于570℃,则Fe粉与水蒸气反应的固体产物为Fe3O4.反应后所得固体的质量为6.88g,其中氧原子的质量为m(O)=6.88g5.60g=1.28g,则n(O)=![]() =0.08mol;由关系式1Fe3O44O,可得n(Fe3O4)=0.02mol;所以固体物质中氧化物的质量分数=img src="http://thumb.zyjl.cn/questionBank/Upload/2020/06/01/06/3ffb4c7e/SYS202006010602203154565325_DA/SYS202006010602203154565325_DA.006.png" width="265" height="47" style="-aw-left-pos:0pt; -aw-rel-hpos:column; -aw-rel-vpos:paragraph; -aw-top-pos:0pt; -aw-wrap-type:inline" />=67.4%,
=0.08mol;由关系式1Fe3O44O,可得n(Fe3O4)=0.02mol;所以固体物质中氧化物的质量分数=img src="http://thumb.zyjl.cn/questionBank/Upload/2020/06/01/06/3ffb4c7e/SYS202006010602203154565325_DA/SYS202006010602203154565325_DA.006.png" width="265" height="47" style="-aw-left-pos:0pt; -aw-rel-hpos:column; -aw-rel-vpos:paragraph; -aw-top-pos:0pt; -aw-wrap-type:inline" />=67.4%,
答案为:67.4%。

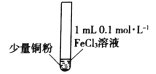
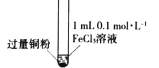
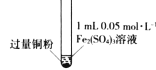
【题目】某小组同学通过实验研究FeCl3溶液与Cu粉发生的氧化还原反应。实验记录如下:
序号 | I | II | III |
实验步骤 |
充分振荡,加入2mL蒸馏水 |
充分振荡,加入2mL蒸馏水 |
充分振荡,加入2mL蒸馏水 |
实验现象 | 铜粉消失,溶液黄色变浅,加入蒸馏水后无明显现象 | 铜粉有剩余,溶液黄色褪去,加入蒸馏水后生成白色沉淀 | 铜粉有剩余,溶液黄色褪去,变成蓝色,加入蒸馏水后无白色沉淀 |
下列说法不正确的是
A. 实验I、II、III中均涉及Fe3+被还原
B. 对比实验I、II说明白色沉淀的产生与铜粉的量有关
C. 实验II、III中加入蒸馏水后c(Cu2+)相同
D. 向实验III反应后的溶液中加入饱和NaCl溶液可能出现白色沉淀
【题目】氟化铬可用作毛织品防蛀剂、卤化催化剂、大理石硬化及着色剂。以铬云母矿石(含4.5%Cr2O3,还含Fe2O3、FeO、MgO、SiO2)为原料制备氟化铬的工艺流程如下。
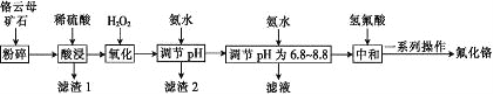
下表列出了相关金属离子生成氢氧化物沉淀的pH:
氢氧化物 | Fe(OH)3 | Mg(OH)2 | Cr(OH)3 | Fe(OH)2 |
开始沉淀的pH | 2.3 | 8.8 | 4.9 | 7.5 |
沉淀完全的pH | 4.1 | 10.4 | 6.8 | 9.7 |
请回答下列问题:
(1)将铬云母矿石粉碎的目的是___________。
(2)Cr2O3与稀硫酸反应的化学方程式为________________。
(3)第一次滴加氨水调节pH范围为______。
(4)第二次滴加氨水调节pH 为6.8~8.8的目的是___________,Cr(OH)3与 Al(OH)3 一样具有两性,若第二次滴加的氨水改为NaOH溶液,生成的Cr(OH)3会部分溶解,写出Cr(OH)3溶解的离子方程式:___________。