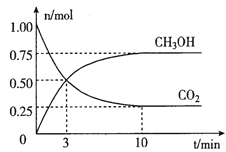
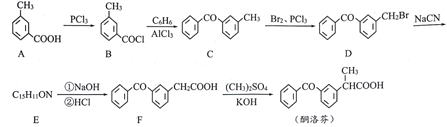
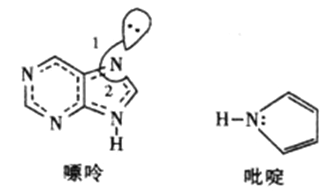
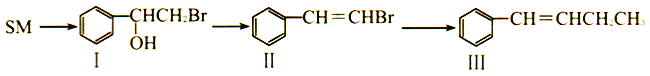��Ŀ����
����Ŀ��[��ѧ����ѡ��3�����ʽṹ������]̼�ǵ���������������������Ԫ��֮һ������Ҫ��ش��������⣺
(1)̼ԭ�ӵļ۵����Ų�ʽ______________��������_________�ֲ�ͬ�˶�״̬�ĵ��ӡ�
(2)̼�����γɶ����л��������ͼ��ʾ��һ�����ʺ�һ����वĽṹ�����ַ���������ԭ�Ӷ���һ��ƽ���ϡ�
������������Ԫ�صĵ縺���ɴ�С��˳��__________________��
�������й��֮��ļнǡ�1�ȡ�2����ԭ��__________________��
����ऽṹ��Nԭ�ӵ��ӻ���ʽ__________________��
�ܷ����еĴ�м����÷��Ŧ�![]() ��ʾ��m�����γɴ�м���ԭ������n���������γɴ�м��ĵ�����������ऽṹ�еĴ�м���ʾΪ__________��
��ʾ��m�����γɴ�м���ԭ������n���������γɴ�м��ĵ�����������ऽṹ�еĴ�м���ʾΪ__________��
(3)̼Ԫ�����γ�CO��CO2��H2CO3�ȶ����������
�ٶ�����̼�ľ�������ɱ���ÿ��������̼������Χͨ����__________�����ڵķ��ӡ�
����COת����CO2�ķ�Ӧ�����У�����˵����ȷ����__________��
A.�����йµ��Ӷ������� B.���ӵļ��Է����仯
C.ԭ�Ӽ�ɼ���ʽ�����ı� D.���Ӿ�����۷е�����
��H2CO3��H3PO4����1�����ǻ�����H3PO4Ϊ��ǿ�ᣬH2CO3Ϊ�����ԭ��_________��
(4)2017�꣬�����ѧ���Ŷӹ�ͬ�ϳ���̼��һ������ͬ�������壺T-̼��T-̼�Ľṹ�ǽ��������ʯ�е�ÿ��̼ԭ����һ����4��̼ԭ����ɵ���������ṹ��Ԫȡ���γ�̼��һ��������ά��������ṹ������ͼ����֪T̼��������Ϊa pm������٤������ΪNA����T̼���ܶȵı���ʽΪ__________g/cm3��(д������ʽ����)

���𰸡� 2S22P2 6 N<C>H(��NCH) �µ��Ӷ�����ϵ��Ӷ�֮��ij������ڼ��ϵ��Ӷ�֮��ij�����������Ǵ� sp2 ![]() 12 BCD ����Һ��ˮ������̼����ֻ��Լ���ٷ�֮һ��ˮ��ϳ�̼���밴������̼ȫ��ת��Ϊ̼��������������ǿ�������Ȼ��С�˽��ٱ���
12 BCD ����Һ��ˮ������̼����ֻ��Լ���ٷ�֮һ��ˮ��ϳ�̼���밴������̼ȫ��ת��Ϊ̼��������������ǿ�������Ȼ��С�˽��ٱ��� ![]()
��������(1)̼Ϊ6��Ԫ�أ�ԭ�ӵļ۵����Ų�ʽΪ2S22P2��������6�ֲ�ͬ�˶�״̬�ĵ��ӣ�(2) ��Ԫ�طǽ�����Խǿ�縺��Խǿ��������������Ԫ�صĵ縺���ɴ�С��˳��ΪN<C>H���ڹµ��Ӷ�����ϵ��Ӷ�֮��ij������ڼ��ϵ��Ӷ�֮��ij�����������Ǵ������й��֮��ļнǡ�1�ȡ�2�����N������̼�ɼ�����һ��δ�ɶԵ��Ӻ��������̼ԭ���γɴ�м�![]() ����˷��������Ե�Sp2�ӻ����ܷ����еĴ�м����÷���
����˷��������Ե�Sp2�ӻ����ܷ����еĴ�м����÷���![]() ��ʾ��m�����γɴ�м���ԭ������n���������γɴ�м��ĵ�����������ऽṹ�еĴ�м���ʾΪ
��ʾ��m�����γɴ�м���ԭ������n���������γɴ�м��ĵ�����������ऽṹ�еĴ�м���ʾΪ![]() ��(3)�ٸɱ��Ƿ��Ӿ��壬CO2����λ��������Ķ���������ϣ��Զ����ϵ�CO2����Ϊ�����������������CO2���ӷֲ�����ö���������12����������ϣ�����COת����CO2�ķ�Ӧ�����У� A.�����йµ��Ӷ�����2�Ա�Ϊ4�ԣ������仯��ѡ��A���� B.���ӵļ��Է����仯���ɼ��Է��ӱ�Ϊ�Ǽ��Է��ӣ�ѡ��B��ȷ��C.ԭ�Ӽ�ɼ���ʽ�����ı䣬��Ϊ̼��˫����ѡ��C��ȷ��D.���Ӿ�����۷е����ߣ�ѡ��D��ȷ����ѡBCD����H2CO3��H3PO4����1�����ǻ�����H3PO4Ϊ��ǿ�ᣬH2CO3Ϊ�����ԭ��Ϊ����Һ��ˮ������̼����ֻ��Լ���ٷ�֮һ��ˮ��ϳ�̼���밴������̼ȫ��ת��Ϊ̼��������������ǿ�������Ȼ��С�˽��ٱ��ˣ�(4) ����ԭ�Ӿ�̯���ɼ���T̼�����к���̼ԭ�Ӹ���Ϊ
��(3)�ٸɱ��Ƿ��Ӿ��壬CO2����λ��������Ķ���������ϣ��Զ����ϵ�CO2����Ϊ�����������������CO2���ӷֲ�����ö���������12����������ϣ�����COת����CO2�ķ�Ӧ�����У� A.�����йµ��Ӷ�����2�Ա�Ϊ4�ԣ������仯��ѡ��A���� B.���ӵļ��Է����仯���ɼ��Է��ӱ�Ϊ�Ǽ��Է��ӣ�ѡ��B��ȷ��C.ԭ�Ӽ�ɼ���ʽ�����ı䣬��Ϊ̼��˫����ѡ��C��ȷ��D.���Ӿ�����۷е����ߣ�ѡ��D��ȷ����ѡBCD����H2CO3��H3PO4����1�����ǻ�����H3PO4Ϊ��ǿ�ᣬH2CO3Ϊ�����ԭ��Ϊ����Һ��ˮ������̼����ֻ��Լ���ٷ�֮һ��ˮ��ϳ�̼���밴������̼ȫ��ת��Ϊ̼��������������ǿ�������Ȼ��С�˽��ٱ��ˣ�(4) ����ԭ�Ӿ�̯���ɼ���T̼�����к���̼ԭ�Ӹ���Ϊ![]() ��
��  ��
��