题目内容
(8分)硫酸的性质有:
(1)实验室干燥氢气___________________;
(2)浓硫酸与金属铜的反应________________;
(3)实际生产中,浓硫酸可用钢瓶贮运_________;
(4)浓硫酸使蔗糖变黑,且有刺激性气味的气体产生_______________。
| A.强酸性; | B.吸水性; | C.脱水性; | D.强氧化性。在下列硫酸的用途或化学反应中,硫酸可能表现上述的一个或者多个性质,试用字母填空: |
(2)浓硫酸与金属铜的反应________________;
(3)实际生产中,浓硫酸可用钢瓶贮运_________;
(4)浓硫酸使蔗糖变黑,且有刺激性气味的气体产生_______________。

硫酸

练习册系列答案
相关题目
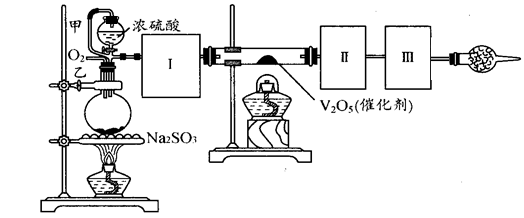
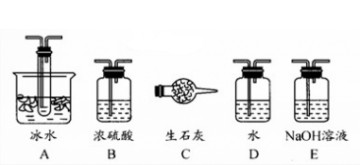
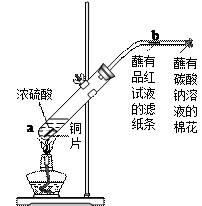
 ]探究浓硫酸的氧化性
]探究浓硫酸的氧化性 _______________________ ___。
_______________________ ___。
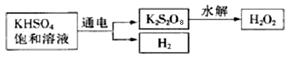
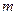 g铜与足量浓H2SO4共热时恰好完全反应,在标准状况下生成
g铜与足量浓H2SO4共热时恰好完全反应,在标准状况下生成 L气体,则被还原的H2SO4的量是
L气体,则被还原的H2SO4的量是 mol
mol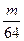 mol
mol g
g g
g 等于100mL
等于100mL