题目内容
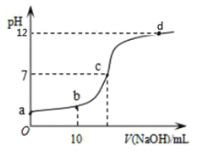
【题目】常温时,100 mL 0.10 mol·L-1 H2A溶液用0.10 mol·L-1NaOH溶液滴定,滴定曲线如图所示。已知:p![]() = -lg
= -lg![]() 。下列说法不正确的是
。下列说法不正确的是

A.水的电离程度:Y>X>W
B.NaHA溶液呈酸性
C.反应H2A+A2- ![]() 2HA-的平衡常数K=105.6
2HA-的平衡常数K=105.6
D.Y点溶液中:c (Na+)=c (OH-)+3c (HA-)-c (H+)
【答案】C
【解析】
第一次反应终点:![]() ,第二次反应终点:
,第二次反应终点:![]() ,第二次反应终点pH=11.9,为碱性,即
,第二次反应终点pH=11.9,为碱性,即![]() 为强碱弱酸盐,
为强碱弱酸盐,![]() 为弱酸,且第一步电离为
为弱酸,且第一步电离为![]() ,
,![]() ,第二步电离为
,第二步电离为![]() ,
,![]() ,W点溶质为
,W点溶质为![]() 、
、![]() ,X点溶质为
,X点溶质为![]() ,Y点溶质为
,Y点溶质为![]() 、
、![]() 。
。
A. W、X、 Y三点均含![]() ,而W点还含
,而W点还含![]() ,酸对水的电离起抑制作用,而Y点还有
,酸对水的电离起抑制作用,而Y点还有![]() ,
,![]() 的水解对水的电离起促进作用,故水的电离程度:Y>X>W,A正确;
的水解对水的电离起促进作用,故水的电离程度:Y>X>W,A正确;
B. NaHA溶液中存在:![]() ,
,![]() 还存在:
还存在:![]()
![]() ,
,![]() >
>![]() 以电离为主,呈酸性,B正确;
以电离为主,呈酸性,B正确;
C. 反应H2A+A2-![]() 2HA-的平衡常数
2HA-的平衡常数![]() ,C不正确;
,C不正确;
D. Y点溶液中溶质为![]() 、
、![]() ,根据电荷守恒:c (H+)+c (Na+)=c (OH-)+c (HA-)+2 c (A2-),由图可知在Y点,c (HA-)=c (A2-),则c (H+)+c (Na+)=c (OH-)+3c (HA-),再移项得:c (Na+)=c (OH-)+3c (HA-)-c (H+),D正确。
,根据电荷守恒:c (H+)+c (Na+)=c (OH-)+c (HA-)+2 c (A2-),由图可知在Y点,c (HA-)=c (A2-),则c (H+)+c (Na+)=c (OH-)+3c (HA-),再移项得:c (Na+)=c (OH-)+3c (HA-)-c (H+),D正确。
答案选C。

练习册系列答案
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案
相关题目