题目内容
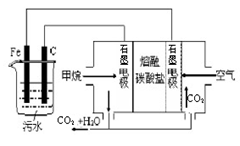
如下图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。请按要求回答相关问题:
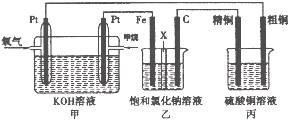
(1)甲烷燃料电池负极电极反应式是:
(2)石墨电极(C)的电极反应式为
(3)若在标准状况下,有2. 24 L氧气参加反应,则乙装置中铁电极上生成的气体体积为_ L;丙装置中阴极析出铜的质量为 g
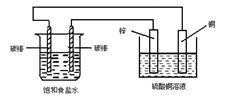
(4)某同学利甲烷燃料电池设计电解法制取漂白液或Fe(OH)2的实验装置(如图所示)。若用于制漂白液时a为电池_ 极,电解质溶液最好用_ 。若用于制 Fe(OH)2,使用硫酸钠做电解质溶液,阳极选用 作电极。


(1)甲烷燃料电池负极电极反应式是:
(2)石墨电极(C)的电极反应式为
(3)若在标准状况下,有2. 24 L氧气参加反应,则乙装置中铁电极上生成的气体体积为_ L;丙装置中阴极析出铜的质量为 g
(4)某同学利甲烷燃料电池设计电解法制取漂白液或Fe(OH)2的实验装置(如图所示)。若用于制漂白液时a为电池_ 极,电解质溶液最好用_ 。若用于制 Fe(OH)2,使用硫酸钠做电解质溶液,阳极选用 作电极。

(1)CH4-8e-+10OH-=CO32-+7H2O
(2)2Cl--2e-=Cl2↑
(3)4.48 12.8
(4)负 饱和氯化钠溶液或食盐水 铁
(2)2Cl--2e-=Cl2↑
(3)4.48 12.8
(4)负 饱和氯化钠溶液或食盐水 铁
试题分析:甲为燃料电池,甲烷通入一极为负极,氧气通入一极为正极;乙为电解池,Fe为阴极,C为阳极,实质为电解饱和食盐水;丙为电解池,粗铜为阳极,精铜为阴极,实质为精炼铜。
(1)注意在碱性环境中进行的电极反应产物为CO32-;
(2)石墨电极(C)的电极为阳极,阴离子放电;
(3)标准状况下,2.24L氧气的物质的量为0.1mol,参与反应转移电子数为0.4mol ;铁电极为阴极,阳离子放电:2H++2e-=H2,则放出氢气0.2mol,即为4.48L;丙装置中阴极反应式为:Cu2++2e-=Cu,则析出铜0.2mol,即为12.8g。
(4)用于制漂白液时利用电解饱和氯化钠溶液或食盐水,同时利用生成的NaOH溶液吸收生成的Cl2进而生成漂白液,因此Cl2要在B极生成才可被NaOH溶液吸收完全。 用于制Fe(OH)2时需要铁做阳极放电生成亚铁离子:Fe-2e-=Fe2+

练习册系列答案
相关题目
 H2
H2 Li1-xCoO2+LixC6。下列有关说法正确的是
Li1-xCoO2+LixC6。下列有关说法正确的是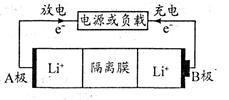
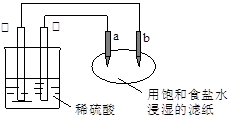
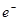 = 2H+
= 2H+