题目内容
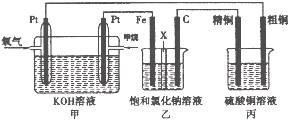
已知外电路中,电子由铜流向a极。有关下图所示的装置分析合理一项是( )
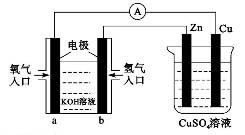

| A.该装置中Cu极为正极 |
| B.当铜极的质量变化为12.8 g时,a极上消耗的O2在标准状况下的体积为2.24 L |
C.b极反应的电极反应式为:H2一2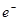 = 2H+ = 2H+ |
| D.一段时间后锌片质量减少 |
B
试题分析:外电路中,电子由铜流向a极,故铜为负极,A错误;a极为正极,b极为负极,锌为正极;当铜极的质量变化为12.8 g时,即有0.2mol的铜溶解,转移0.4mol电子,故a极上消耗的O2在标准状况下的体积为2.24 L,B正确;b极为负极,氢气发生氧化反应,但是该电解质为碱性溶液,氧化产物不可能是氢离子,而是水,C错误;锌片是正极,质量不会减少,表面还会附着铜,D错误。
点评:原电池是历年高考常考知识点,注重考查学生分析问题、解决问题的能力。

练习册系列答案
相关题目
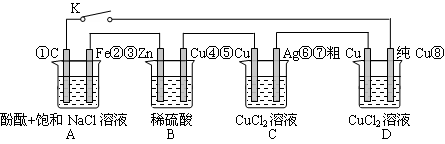

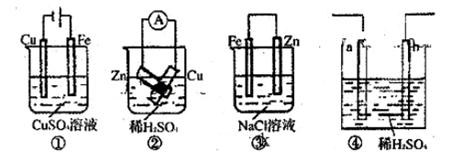
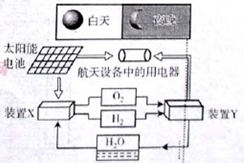
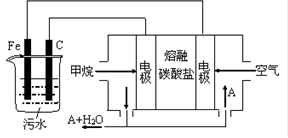
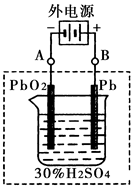
 2PbSO4+2H2O回答下列 问题。(不考虑氢、氧的氧化还原)
2PbSO4+2H2O回答下列 问题。(不考虑氢、氧的氧化还原)