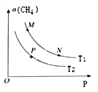
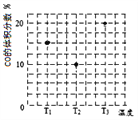
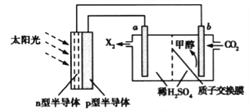
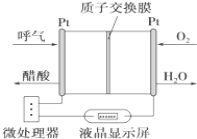
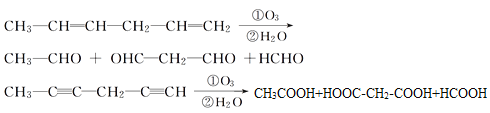
题目内容
【题目】下列说法中,可以证明反应 N2+3H2![]() 2NH3 已达平衡状态的是( )
2NH3 已达平衡状态的是( )
A. 一个N≡N键断裂的同时,有三个H-H键形成
B. 一个N≡N键断裂的同时,有三个H-H键断裂
C. 一个N≡N键断裂的同时,有两个N-H键断裂
D. 一个N≡N键断裂的同时,有六个N-H键形成
【答案】A
【解析】
A. 断裂N≡N键代表正反应速率,形成H-H键表示逆反应速率,一个N≡N键断裂的同时,有三个H-H键形成,表示正逆反应速率相等,反应达到平衡状态,故A正确;B. 断裂N≡N键代表正反应速率,断裂H-H键也表示正反应速率,不能说明正逆反应速率的关系,故B错误;C. 断裂N≡N键代表正反应速率,断裂N-H键表示逆反应速率,一个N≡N键断裂的同时,有两个N-H键断裂,说明正反应速率大于逆反应速率,不是平衡状态,故C错误;D. 断裂N≡N键代表正反应速率,形成N-H键表示正反应速率,不能说明正逆反应速率的关系,故D错误;故选A。

 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案【题目】元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用。下表是元素周期表的一部分。
H | He | ||||||
Li | Be | B | C | N | O | F | Ne |
Na | Mg | Al | Si | P | S | Cl | Ar |
请回答下列问题。
(1)非金属性最强的元素名称为___________,它位于元素周期表中的位置___________。
(2)硅元素的原子结构示意图是____________,其最高价氧化物是____________(填“酸性”或“碱性”)氧化物。
(3)硼酸(H3BO3)的酸性_________(填“>” 或“<”)碳酸(H2CO3)的酸性,说明你判断的理由:__________________________。
(4)NH3的电子式为________________,它属于____________(填“离子”或“共价”)化合物。NH3的还原性_________(填“>” 或“<”)PH3的还原性。
(5)第三周期元素的最高价氧化物对应的水化物中,有一种物质既能与强酸反应又能与强碱反应,写出这种物质跟氢氧化钠溶液反应的化学方程式______________。