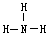题目内容
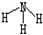
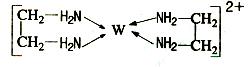
(11分)X、Y、Z、V、W为五种前四周期元素,其中X是短周期(除稀有气体外)原子半径最大的元素;Y与X同周期,其最高价氧化物的水化物呈两性;Z原子基态时2p原子轨道上有3个未成对的电子;V原子的核外电子排布式为ls22s22p63s2;W的原子序数为29,W的离子能与乙二胺(H2N—CH2—CH2—NH2)形成配离子:
回答下列问题:
(1)W原子的核外电子排布式为 ,该配离子中含有的化学键类型有 。(填字母)
a.配位键 b.极性键 c.离子键 d.非极性键
(2)元素X、Y、V第一电离能由大到小的顺序是 (用元素符号表示)。
(3)Z的氢化物的空间构型是 ;该氢化物的沸点比甲烷的高,其主要原因是
(4)一定压强,将HF和HCl混合气体降温时,首先液化的物质是
(5)已知XeO3分子中氙原子上有1对孤对电子,则XeO3为_________分子(填“极性”或
“非极性”);XeO3分子中中心原子的杂化类型为 ;XeO3分子实际空间构型为

回答下列问题:
(1)W原子的核外电子排布式为 ,该配离子中含有的化学键类型有 。(填字母)
a.配位键 b.极性键 c.离子键 d.非极性键
(2)元素X、Y、V第一电离能由大到小的顺序是 (用元素符号表示)。
(3)Z的氢化物的空间构型是 ;该氢化物的沸点比甲烷的高,其主要原因是
(4)一定压强,将HF和HCl混合气体降温时,首先液化的物质是
(5)已知XeO3分子中氙原子上有1对孤对电子,则XeO3为_________分子(填“极性”或
“非极性”);XeO3分子中中心原子的杂化类型为 ;XeO3分子实际空间构型为
(1)[Ar]3d104s1(或1s22s22p63s23p63d104s1)(1分);abd(2分)
(2)Mg>Al>Na(2分)
(3)三角锥形(1分);氨分子间存在氢键(1分)。
(4)HF先液化
(5)极性 sp3, 三角锥形
(2)Mg>Al>Na(2分)
(3)三角锥形(1分);氨分子间存在氢键(1分)。
(4)HF先液化
(5)极性 sp3, 三角锥形
考查原子核外电子的排布规律及其应用等。根据X的原子半径可知X是Na。Y是Al。根据构造原理可知Z是N,V是Mg。W是Cu。
(1)由构造原理可知铜原子的核外电子排布是1s22s22p63s23p63d104s1。根据结构简式可知化学键是配位键、极性键(C-H、N-H、N-C)和非极性键(C-C)。
(2)镁的3s电子是全充满,稳定性强,电离能最大,所以顺序是Mg>Al>Na。
(3)氨气中心原子N原子含有1对孤对电子,属于三角锥形。氨气中含有氢键,所以沸点高于甲烷的。
(4)氟化氢中存在氢键,所以熔沸点高于氯化氢的,因此首先液化的是HF。
(5)在XeO3分子中Xe形成3个极性键,又因为氙原子上有1对孤对电子,因此是sp3杂化,所以空间构型是三角锥形,属于极性分子。
(1)由构造原理可知铜原子的核外电子排布是1s22s22p63s23p63d104s1。根据结构简式可知化学键是配位键、极性键(C-H、N-H、N-C)和非极性键(C-C)。
(2)镁的3s电子是全充满,稳定性强,电离能最大,所以顺序是Mg>Al>Na。
(3)氨气中心原子N原子含有1对孤对电子,属于三角锥形。氨气中含有氢键,所以沸点高于甲烷的。
(4)氟化氢中存在氢键,所以熔沸点高于氯化氢的,因此首先液化的是HF。
(5)在XeO3分子中Xe形成3个极性键,又因为氙原子上有1对孤对电子,因此是sp3杂化,所以空间构型是三角锥形,属于极性分子。

练习册系列答案
相关题目