题目内容
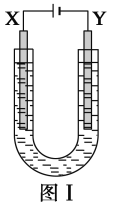
【题目】分析如图所示的四个原电池装置,其中结论正确的是( )
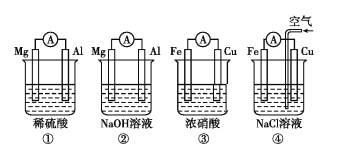
A.①②中Mg作负极,③④中Fe作负极
B.②中Mg作正极,电极反应式为6H2O+6e-=6OH-+3H2↑
C.③中Fe作负极,电极反应式为Fe-3e-=Fe3+
D.④中Cu作正极,电极反应式为2H++2e-=H2↑
【答案】B
【解析】
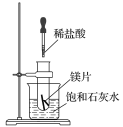
装置①中,电解质液为稀硫酸,镁的活泼性强于铝,故Mg作负极;装置②中,电解质液为氢氧化钠溶液,镁不能与其反应,故Al作负极;装置③中,铁与浓硝酸钝化,故Cu作负极;装置④中,发生吸氧腐蚀,Fe作负极。
A.装置②中Al作负极,装置③中,铁与浓硝酸钝化,故Cu作负极,A错误;
B.装置②中Al作负极,Mg作正极,电极反应式为6H2O+6e-=6OH-+3H2↑,B正确;
C.装置③中Cu作负极,C错误;
D.装置④中Fe作负极,Cu作正极,电极反应式为O2+2H2O+4e-=4OH-,D错误;
答案选B。

练习册系列答案
相关题目
【题目】由A、B、C、D四种金属按下表中装置进行实验。
装置 |
|
|
|
现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是______________________________________。
(2)装置乙中正极的电极反应式是_______________________________________。
(3)装置丙中溶液的pH________(填“变大”、“变小”或“不变”)。
(4)四种金属活动性由强到弱的顺序是___________________________________。