题目内容
【题目】某学生设计氨催化氧化实验,并将制得NO进一步氧化为NO2用水吸收NO2,并检验HNO3的生成。
可供选择的固体药品有:NH4Cl、Ca(OH)2、KClO3、MnO2、CaO
可供选择的液体药品有:浓氨水、过氧化氢、浓盐酸、水
可供选择的仪器有:如图
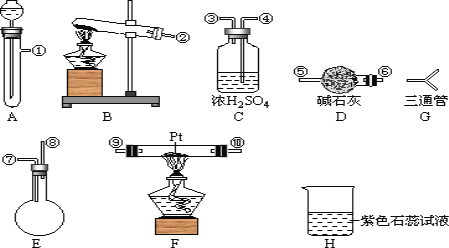
另有铁架台、铁夹、铁圈、乳胶管若干,可供选择。设计实验时,A和B两个制气装置允许使用两次,其余装置只能使用一次。
(1)氨氧化制NO的化学反应为__________________________,该反应应在装置____中进行。
(2)为快速制NH3和O2,制取NH3的装置最好选择_______,其化学反应方程式为______________;制取O2的装置最好选择_______。
(3)装置C的作用是___________________。
(4)装置H中溶液变红,其原因是(用化学方程式表示)______________________。
【答案】4NH3+5O2![]() 4NO+6H2OFANH3·H2O(浓)+CaO=NH3↑+Ca(OH)2A吸收多余NH3及生成 H2O4NO2+O2+2H2O=4HNO3
4NO+6H2OFANH3·H2O(浓)+CaO=NH3↑+Ca(OH)2A吸收多余NH3及生成 H2O4NO2+O2+2H2O=4HNO3
【解析】
(1)氨气与氧气在催化剂条件下加热生成一氧化氮和水,根据反应条件和反应物状态选择装置;
(2)要快速制备氨气,则应该是将生石灰加入到浓氨水中,据此选择装置及写出方程式;双氧水在催化剂条件下,不需要加热就会迅速产生大量氧气,据反应物状态和反应条件选择发生装置;
(3)氨气与浓硫酸反应,可以用浓硫酸吸收过量的氨气和气体中的水蒸气;
(4)因为NO2和剩余的氧气溶于水会有硝酸生成,溶液显酸性,因此石蕊试液变为红色。
(1)氨气与氧气在催化剂条件下加热生成一氧化氮和水,化学方程式为: 4NH3+5O2![]() 4NO+6H2O;因为是两种气体之间的反应,所以根据装置的特点可以知道,应选择装置F制备;因此本题答案是:4NH3+5O2
4NO+6H2O;因为是两种气体之间的反应,所以根据装置的特点可以知道,应选择装置F制备;因此本题答案是:4NH3+5O2![]() 4NO+6H2O;F。
4NO+6H2O;F。
(2)要快速制备氨气,则应该是将生石灰加入到浓氨水中,所以选择的装置是A,反应的化学方程式是NH3·H2O(浓)+CaO=NH3↑+Ca(OH)2 ;双氧水在催化剂条件下,不需要加热就会迅速产生大量氧气,反应物状态为固体与液体,条件不加热,选择装置A;综上所述,本题答案是:A ,NH3·H2O(浓)+CaO=NH3↑+Ca(OH)2,A。
(3)C中的浓硫酸用来吸收过量的氨气,干燥气体吸收水蒸气;因此,本题正确答案是: 吸收多余NH3及生成 H2O。
(4)因为NO2和剩余的氧气溶于水会有硝酸生成,溶液显酸性,因此石蕊试液变为红色,反应的化学方程式是: 4NO2+O2+2H2O=4HNO3;因此本题答案是:4NO2+O2+2H2O=4HNO3。

 阅读快车系列答案
阅读快车系列答案【题目】Ⅰ.已知:反应aA(g)+bB(g)cC(g),某温度下,在 2 L 的密闭容器中投入一定量的A、B,两种气体的物质的量浓度随时间变化的曲线如图所示。

(1)经测定前4 s内v(C)=0.05 mol·L1·s1,则该反应的化学方程式为______________。
(2)若上述反应分别在甲、乙、丙三个相同的密闭容器中进行,经同一段时间后,测得三个容器中的反应速率分别为甲:v(A)=0.3 mol·L1·s1;乙:v(B)=0.12 mol·L1·s1;丙:v(C)=9.6 mol·L1·min1,则甲、乙、丙三个容器中反应速率由快到慢的顺序为___________(用甲、乙、丙表示)。
Ⅱ.为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验,请回答下列问题。
编号 | 操作 | 实验现象 |
① | 分别在试管A、B中加入5 mL 5% H2O2溶液,各滴入1~2 滴1 mol/L FeCl3溶液。待试管中均有适量气泡出现时,将试管A放入盛有5 ℃左右冷水的烧杯中;将试管B放入盛有40 ℃左右热水的烧杯中 | 试管A中不再产生气泡试管B中产生的气泡量增大 |
② | 另取两支试管分别加入5 mL 5% H2O2溶液和5 mL 10% H2O2溶液 | 试管A、B中均未见气泡产生 |
(3)实验①的目的是_______________________________,实验中滴加FeCl3溶液的目的是____________________________。
(4)实验②未观察到预期的实验现象,为了帮助该同学达到实验目的,你提出的对上述操作的改进意见是______________________________________________________________(用实验中所提供的几种试剂)。

(5)某同学在50 mL H2O2 溶液中加入一定量的二氧化锰,放出气体的体积(标准状况)与反应时间的关系如右图所示,则A、B、C三点所表示的即时反应速率最慢的是______。