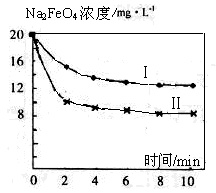
题目内容
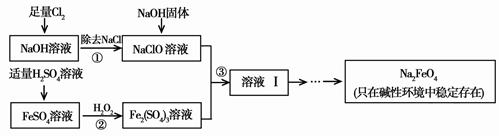
废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废旧黄铜(Cu、Zn合金,含少量杂质Fe)制备胆矾晶体(CuSO4·5H2O)及副产物ZnO。制备流程图如下:

已知:Zn及化合物的性质与Al及化合物的性质相似,pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol·L-1计算)。
请回答下列问题:
(1)试剂X可能是__________,其作用是____________________。
(2)加入ZnO调节pH=3~4的目的是____________________。
(3)由不溶物生成溶液D的化学方程式为______________________________。
(4)由溶液D制胆矾晶体包含的主要操作步骤是______________________________。
(5)下列试剂可作为Y试剂的是______。
A.ZnO B.NaOH C.Na2CO3 D.ZnSO4
若在滤液C中逐滴加入盐酸直到过量,则产生的现象是______________________________。
(6)测定胆矾晶体的纯度(不含能与I-发生反应的氧化性杂质):准确称取0.5000g胆矾晶体置于锥形瓶中,加适量水溶解,再加入过量KI,用0.1000mol·L-1Na2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液19.40mL。已知:上述滴定过程中的离子方程式如下:
2Cu2++4I- 2CuI(白色)↓+I2,I2+2S2O32-
2CuI(白色)↓+I2,I2+2S2O32- 2I-+S4O62-
2I-+S4O62-
①胆矾晶体的纯度为_______________。
②在滴定过程中剧烈摇动(溶液不外溅)锥形瓶,则所测得的纯度将会__________(填“偏高”、“偏低”或“不变”)。

已知:Zn及化合物的性质与Al及化合物的性质相似,pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol·L-1计算)。
| | Fe3+ | Fe2+ | Zn2+ |
| 开始沉淀的pH | 1.1 | 5.8 | 5.9 |
| 沉淀完全的pH | 3.0 | 8.8 | 8.9 |
请回答下列问题:
(1)试剂X可能是__________,其作用是____________________。
(2)加入ZnO调节pH=3~4的目的是____________________。
(3)由不溶物生成溶液D的化学方程式为______________________________。
(4)由溶液D制胆矾晶体包含的主要操作步骤是______________________________。
(5)下列试剂可作为Y试剂的是______。
A.ZnO B.NaOH C.Na2CO3 D.ZnSO4
若在滤液C中逐滴加入盐酸直到过量,则产生的现象是______________________________。
(6)测定胆矾晶体的纯度(不含能与I-发生反应的氧化性杂质):准确称取0.5000g胆矾晶体置于锥形瓶中,加适量水溶解,再加入过量KI,用0.1000mol·L-1Na2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液19.40mL。已知:上述滴定过程中的离子方程式如下:
2Cu2++4I-
 2CuI(白色)↓+I2,I2+2S2O32-
2CuI(白色)↓+I2,I2+2S2O32- 2I-+S4O62-
2I-+S4O62-①胆矾晶体的纯度为_______________。
②在滴定过程中剧烈摇动(溶液不外溅)锥形瓶,则所测得的纯度将会__________(填“偏高”、“偏低”或“不变”)。
(1)H2O2(新制氯水等氧化剂,其它合理答案也给分)(1分),将 Fe2+氧化为 Fe3+(2分)
(2)与H+反应,降低H+浓度,促使Fe3+彻底水解生成 Fe(OH)3沉淀而除去。(2分)
(3)Cu+H2O2+H2SO4 =CuSO4+2H2O(2分)
(4)蒸发浓缩、冷却结晶、抽滤(2分)
(5)B(1分),先产生白色沉淀后溶解(1分)(6)①97.00% (2分)②偏高(2分)
(2)与H+反应,降低H+浓度,促使Fe3+彻底水解生成 Fe(OH)3沉淀而除去。(2分)
(3)Cu+H2O2+H2SO4 =CuSO4+2H2O(2分)
(4)蒸发浓缩、冷却结晶、抽滤(2分)
(5)B(1分),先产生白色沉淀后溶解(1分)(6)①97.00% (2分)②偏高(2分)
试题分析:(1)废旧黄铜加足量稀硫酸,过滤,滤液中含有Fe2+、Fe3+、Zn2+,不溶物是铜。试剂X的作用是将Fe2+氧化成Fe3+,所以选择绿色氧化剂双氧水。
(2)加入ZnO调节pH=3~4的目的是与H+反应,降低H+浓度,促使Fe3+彻底水解生成 Fe(OH)3沉淀而除去;
(3)根据不溶物是铜,目的是制备胆矾,写出方程式Cu+H2O2+H2SO4 =CuSO4+2H2O;
(4)从溶液中分离出硫酸铜晶体应为蒸发浓缩、冷却结晶、抽滤;
(5)因为pH>11,Y试剂的目的是让Zn(OH)2全部生成[Zn(OH)4]2-,所以Y试剂选用NaOH,滤液C的主要成分是[Zn(OH)4]2-,逐滴加入盐酸直到过量,跟AlO2-溶液中逐滴加入盐酸直到过量进行类推,所以产生的现象是先产生白色沉淀后溶解;
(6)①2 CuSO4·5H2O ~ 2Cu2+ ~ I2 ~ 2S2O32-
1.94×10-3mol 19.40mL×10-3×0.1000mol·L-1
胆矾晶体的质量 1.94×10-3mol ×250g·mol-1=0.485g
胆矾晶体的纯度为0.485g/0.5000g=97.00%
②因为滴定过程中剧烈摇晃锥形瓶会使一部分滴定液残留在玻璃壁上,导致滴定过程中消耗更多的滴定液,所以测得的纯度也会偏高。

练习册系列答案
相关题目
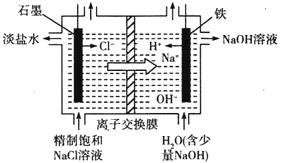
 NaCl+K,通过调整温度,可利用金属Na来制取K。
NaCl+K,通过调整温度,可利用金属Na来制取K。