题目内容
【题目】合成氨是人类科学技术上的一项重大突破,其反应原理为:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1一种工业合成氨的简易流程图如下:
2NH3(g) ΔH=-92.4 kJ·mol-1一种工业合成氨的简易流程图如下:
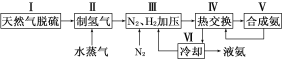
(1)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式:___________________________。
(2)步骤Ⅱ中制氢气原理如下:
①CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
②CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
对于反应①,一定可以提高平衡体系中H2百分含量,又能加快反应速率的措施是________。
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
利用反应②,将CO进一步转化,可提高H2产量。若1 mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18 mol CO、CO2和H2的混合气体,则CO转化率为__________________。
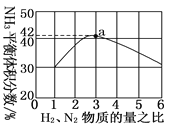
(3)如图表示500 ℃、60.0 MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:________________。
【答案】2NH4HS+O2![]() 2NH3·H2O+2S↓ a 90% 14.5%
2NH3·H2O+2S↓ a 90% 14.5%
【解析】
(1)根据氧化还原反应的规律,进行方程式的配平,NH4HS中-2价的S元素被氧气氧化成S单质,NH4+最终以NH3·H2O形式存在;
(2)根据反应CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1可知,该反应正反应为吸热反应,若提高平衡体系中H2百分含量,需使平衡向正反应方向移动,又能加快反应速率,不能降低压强或减少反应物的浓度,综合影响化学反应速率与化学平衡的各因素分析作答;设CO的转化量为x,列出反应的“三段式”得出其转化率;
CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1可知,该反应正反应为吸热反应,若提高平衡体系中H2百分含量,需使平衡向正反应方向移动,又能加快反应速率,不能降低压强或减少反应物的浓度,综合影响化学反应速率与化学平衡的各因素分析作答;设CO的转化量为x,列出反应的“三段式”得出其转化率;
(3)根据图1可知H2与N2的投料比为3,平衡时NH3体积分数为42%,设H2物质的量为3a mol,N2物质的量为a mol,N2转化的物质的量为x,列出反应的“三段式”得出N2的平衡物质的量分数,因相同条件下,气体的体积之比等于气体的物质的量之比,得出结论。
(1)通入空气后,O2把NH4HS 氧化为S,可得化学方程式:2NH4HS+O2![]() 2NH3·H2O+2S↓,
2NH3·H2O+2S↓,
故答案为:2NH4HS+O2![]() 2NH3·H2O+2S↓;
2NH3·H2O+2S↓;
(2)a. 反应①为吸热反应,升高温度,化学反应速率加快,同时平衡向右移动,使H2的百分含量增大,符合题意,故a正确;
b. 增大水蒸气浓度,平衡虽向右移动,但H2的百分含量会减小,故b错误;
c. 加入催化剂,能加快反应速率,但平衡不移动,则H2的百分含量不变,故c错误;
d. 降低压强,平衡虽向右移动,但反应速率减小,故d错误;
CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
初始量(mol) 0.2 0 0.8
转化量(mol) x x x
剩余量(mol) 0.2-x x 0.8+x
(0.2-x)+x+(0.8+x)=1.18 mol,则x = 0.18 mol,可得CO转化率 = ![]() ×100% = 90%;
×100% = 90%;
(3)根据图1可知H2与N2的投料比为3,平衡时NH3体积分数为42%,设H2物质的量为3a mol,N2物质的量为a mol,N2转化的物质的量为x,则
N2 + 3H2 ![]() 2NH3
2NH3
初始量(mol) a 3a 0
转化量(mol) x 3x 2x
剩余量(mol)a-x 3a-3x 2x
则![]() ÷×100% = 42%,解得x = 0.592 a,则N2的平衡体积分数 =
÷×100% = 42%,解得x = 0.592 a,则N2的平衡体积分数 =![]() ×100% = 14.5%。
×100% = 14.5%。

【题目】短同期主族元素![]() 原子序数依次增大。由这些元素组成的化合物甲、乙、丙、丁的
原子序数依次增大。由这些元素组成的化合物甲、乙、丙、丁的![]() 水溶液
水溶液![]() 如表,丙、丁为二元化合物。甲溶液逐滴滴入丙溶液中,先产生白色沉淀,后沉淀消失;乙的水溶液可除油污。下列说法一定正确的是
如表,丙、丁为二元化合物。甲溶液逐滴滴入丙溶液中,先产生白色沉淀,后沉淀消失;乙的水溶液可除油污。下列说法一定正确的是
| 甲 | 乙 | 丙 | 丁 |
| 13 | 11 | 5 | 1 |
A. 原子半径:![]() B. 配制丙溶液时需加入丁溶液
B. 配制丙溶液时需加入丁溶液
C. 乙溶液去油污时只涉及到盐类的水解D. 海水提镁的过程中一定用到化合物甲